-
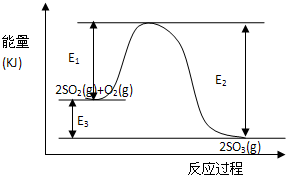
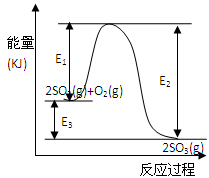
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)AUTOTEXT<=>\*MERGEFORMAT 错误!未找到引用源.2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______.
(2)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)反应______(填“放出”或“吸收”)______热量(用E1、E2或E3表示).
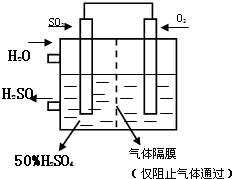
(4)若以右图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______;______.为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)
 2SO3(g)过程中的能量变化如图所示,回答下列问题.
2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同)______.
(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______,反应______(填“放出”或“吸收”)______热量.(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体原子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1______,E2______,E3______(填“增大”“减小”或“不变”).
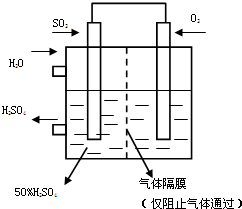
(5)若以如图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______,为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
(6)SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生.写出SOCl2在电池中放电时的电极反应式______.
-
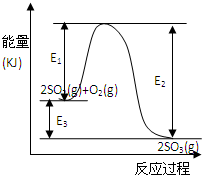
(9分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为________。(1分)
(2)下列叙述能证明该反应已达化学平衡状态的是________(填序号)(2分)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3) 反应________(填“放出”或“吸收”)________热量(用E1、E2或E3表示)(2分)。
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式:

________;________。(2分) [来网]为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为________(2分)
-
反应2SO2 + O2  2SO3是工业生产硫酸的关键步骤,下列说法不正确的
2SO3是工业生产硫酸的关键步骤,下列说法不正确的
A.实际生产中,此反应在接触室进行
B.过量空气能提高SO2的转化率
C.使用催化剂能提高该反应的反应速率
D.2molSO2与1molO2混合一定能生成2molSO3
-
(14分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤。
(1)一定条件下,SO2可发生反应:SO2(g)+  O2(g)
O2(g)  SO3(g) △H=﹣98kJ·mol﹣1。
SO3(g) △H=﹣98kJ·mol﹣1。
①某温度下,在100 L的恒容密闭容器中开始加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=_______(用分数表示)。
②上述反应按照相同的物质的量投料,测得SO2在不同温度下的平衡转化率a%与压强的关系如下图所示。下列说法正确的是_______(填序号)。

A.温度:T3>T2>T1
B.正反应速率:v(c)>v(a),v(b)>v(d)
C.平衡常数:K(a)>k(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
③上述反应达平衡后,保持温度和容器的压强不变,若再通入一定量SO3(g),则SO2的体积分数_______(填“增大”、“减小”、“不变”)。
(2)某人设想以下图所示装置用电化学原理模拟生产硫酸:
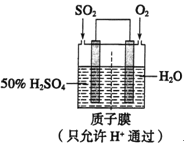
①通入O2的电极是________极。
②写出通入SO2的电极的电极反应式:_______________
③若此过程中转移了0.2mol电子,则质子膜两侧电解液的质量变化差(△m左﹣△m右)为________g(忽略气体的溶解)。
-
硫酸工业中SO2的催化氧化反应2SO2(气)+O2(气) 2SO3(气),在一定条件下达到平衡时,下列说法错误的是( )
2SO3(气),在一定条件下达到平衡时,下列说法错误的是( )
A. SO3的物质的量浓度不变 B. SO2全部转化为SO3
C. 升高温度,平衡会移动 D. 正反应的速率与逆反应的速率相等
-
2SO2(g)+O2(g) 2SO3(g)是工业生产硫酸的重要步骤,T℃时该反应过程中的能量变化如图所示:
2SO3(g)是工业生产硫酸的重要步骤,T℃时该反应过程中的能量变化如图所示:
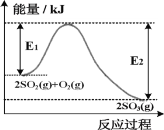
(1)2SO2(g)+O2(g) 2SO3(g)ΔH=___________kJ·mol-1(
2SO3(g)ΔH=___________kJ·mol-1( 含E1、E2的计算式表示)
含E1、E2的计算式表示)
(2)①下列措施不能使该反应速率加快的是___________。
A.升高温度 B.降低压强 C.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是___________。
A.SO3的浓度不再变化
B.SO2与SO3的物质的量相等
C.容器内气体的压强不再变化
D.单位时间内消耗1molO2,同时消耗2molSO2
(3)运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O=2H2SO4,装置如图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
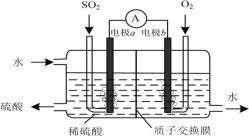
①该电池的负极是___________。(填“电极a”或“电极b”)
②H+通过质子交换膜时的移动方向是___________。
A.从左向右 B.从右向左
③通入O2的电极反应式是___________。
-
工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)⇌2SO3(g).如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是( )
A.SO2完全转化为 SO3
B.消耗2mol SO2的同时生成2mol SO3
C.SO2、O2与SO3 的物质的量之比为 2:1:2
D.SO2、O2与SO3 的浓度不再随时间变化
-
工业制硫酸的关键反应是二氧化硫催化氧化为三氧化硫,其反应方程式2SO2g)+O2(g) 2SO3(g)。回答下列有关问题:
2SO3(g)。回答下列有关问题:
(1)如果此反应用氧气表示的化学反应速率是v(O2)=0.05mol/(L·s),则用二氧化硫表示的v(SO2)=______________.
(2)其它条件不变,若升高温度,此反应会向逆反应方向移动,则正反应速率______________,逆反应速率______________(填增大或减小),正反应是______________反应(填吸热或放热)。
(3)其它条件不变,增大氧气的浓度,会使SO2的转化率______________。
(4)下列条件能够判断此反应已经达到化学平衡状态的是______________
A.单位时间内消耗1molSO2的同时生成1molSO3
B.恒温恒容条件下体系的总压强不在随时间的变化而变化
C.恒温恒容条件下混合气体的密度不再随时间的变化而变化
D.2v(O2)正= v(SO2)逆时
-
在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g)  2SO3(g)+Q,下列叙述中,不正确的是:
2SO3(g)+Q,下列叙述中,不正确的是:
A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快
B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高
C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒
D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量









