-
在学习了化学反应速率知识后,某研究性学习小组进行了科学探究活动。
[探究活动一]探究金属与不同酸反应的反应速率:常温下,用经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。
(1)对[探究活动一]实验现象发生的原因,请你帮该研究性学习小组提出两个假设:
假设Ⅰ_______________________________。
假设Ⅱ_______________________________。
并请你设计实验对以上假设进行验证:
验证假设Ⅰ_______________________________。
验证假设Ⅱ_______________________________。
[探究活动二]某小组在实验室测定氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率。
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的是 .
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: .
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填>、<或=).
(3)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如下图所示.
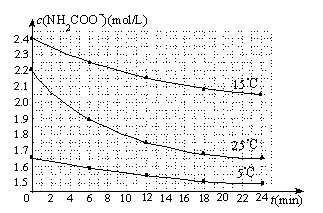
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率: .
⑥根据图中信息,如何说明水解反应速率随温度升高而增大: 。
-
(13分)Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液进行实验,改变条件如下:
| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质 |
| ① | 2 mL | 20 | |
| ② | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 mL | 30 | |
| ④ | 1 mL | 20 | 1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究________对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? ________(填“是”或“否”),请说明理由________。
(2)滴定时用________(填a或b)滴定管盛装KMnO4标准溶液。

(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为________。
-
某学习小组研究“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积 /mL | 温度/℃ | 其它物质 |
| ① | 2 mL | 20 | |
| ② | 2 mL | 20 | 2滴饱和MnSO4溶液 |
| ③ | 2 mL | 30 | |
| ④ | 1 mL | 20 | 1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
【答案】(1)①和② (全对2分);① 和 ③ (全对2分)
(2)草酸的浓度,或反应物的浓度(1分);
确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变(1分)
【解析】
(1)由实验目的可知,探究反应物浓度、温度、催化剂对反应速率影响,需在其他条件相同的条件下做对比实验。同浓度溶液,在相同温度下进行反应,①无催化剂,②有催化剂,故如果研究催化剂对化学反应速率的影响,使用实验①和②;如果研究温度对化学反应速率的影响,需其它条件相同,温度不同,①中温度为20℃,③中温度为30℃,能进行对照实验,故选①和③。(2)对比实验①和④,草酸的体积不同,④中加入了蒸馏水,说明两组实验中的反应物草酸的浓度不同,故对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响;实验④中加入1 mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变。
考点:考查实验探究,外界条件对化学反应速率的影响。
【题型】实验题
【适用】较难
【标题】2015-2016学年四川省雅安市高二上学期期末考试化学试卷(带解析)
【关键字标签】
【结束】
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

-
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=_____,C=_____,E=_____。
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式__________________________________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_____________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,
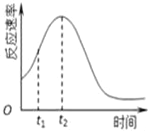
其中t1~t2时间内速率变快的主要原因可能是:
①__________________________________________;
②___________________________________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4·2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。该KMnO4溶液的物质的量浓度为_____mol/L。
-
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=________,C=___________,E=___________
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式_____________________________。
(3)若t1<t2,则根据实验①和②得到的结论是________________________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②_________________。
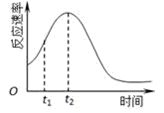
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是:__________;实验中所需的定量仪器有__________(填仪器名称)。该KMnO4溶液的物质的量浓度为________mol/L。
-
(10分)某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失)。若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:
(1)(6分)该实验主要是探究___________________、________和________对反应速率的影响。
(2)(4分)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理。

-
(16分)某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| | 2 mL | 20 | |
| | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| | 2 mL | 30 | |
| ④ | 1 mL | 20 | 1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。

(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
-
(一)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
| 实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s |
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O |
| V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL |
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=_______、T1=______;通过实验______(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_____。
(3)忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=____mol·L-1·min-1。
(二)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2):
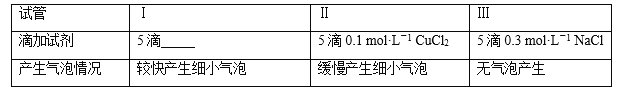
(1)上表试管Ⅰ中应添加的试剂为5滴____________。
(2)结论是_________,实验Ⅲ的目的是__________。
-
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.他们只利用Al、 Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L).设计实验方案来研究影响反应速率的因素。
实验一:甲同学研究的实验报告如下表:

(1)该同学的实验目的是__________________
要得出正确的实验结论,还需控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验
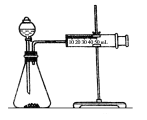
(2)乙同学在实验中应该测定的数据是_____________________。
(3)乙同学完成该实验应选用的实验药品是________________;
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_____________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
-
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| ①分别取等体积的2 mol/L 硫酸于试管中; ②分别投入大小、形状相同 的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究 ________ 对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持________条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
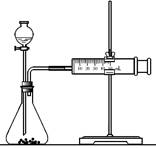
完成该实验应选用的实验药品是________
________;应该测定的实验数据是________。










