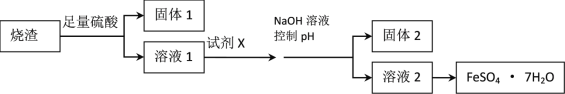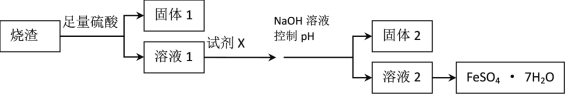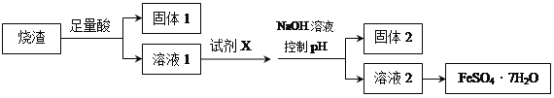-
用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程如下。
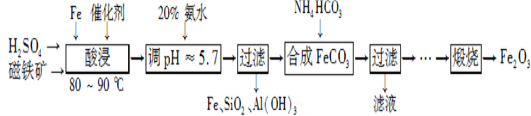
(1) 酸浸时,采用80-90℃的原因 _______________________________________________;
_______________________________________________;
铁粉的作用是____________________________________。
(2) 合成碳酸亚铁的离子方程式__________________________________________________________________。
(3) 图中“滤液”中主要阳离子是_______________________________________________________________;
(4)为了测定磁铁矿中铁的含量,称取80 g的磁铁矿样品加入足量稀硫酸使其充分溶解,过滤,得溶液100mL,取20mL溶液在酸性条件下用0.4 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
①写出滴定时反应的离子方程式__________________________________________
②当溶液中Fe2+ 全部被氧化时,c(Fe3+)=_____________________mol·L-1, (写出计算过程)。
-
用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取FeCO3的工艺流程如下:
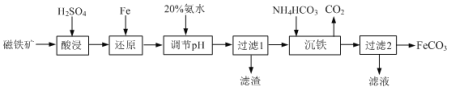
(1)“酸浸”时Fe3O4发生反应的离子反应方程式为 _______ 。
(2)“酸浸”过程中加入过量硫酸的目的是 _______ 和 _______ 。
(3)当溶液中金属离子浓度小于10-5mol·L-1时,则认为金属离子沉淀完全。若还原反应后溶液中c(Fe2+)=0.1 mol·L-1,则常温下加入20%氨水应调pH的范围为 _______ 。{已知:Ksp[Fe(OH)2]=1×10-17,Ksp[Al(OH)3]=1×10-32}
(4)“过滤1”所得滤渣除Fe、Al(OH)3外还有 _______ 。
(5)“沉铁”反应的离子方程式为: _______ 。
(6)若将“沉淀”试剂NH4HCO3改成Na2CO3,则溶液的混合方式为 _______ (填字母)。
A 向“过滤1”的滤液中滴加Na2CO3溶液,并充分搅拌
B 向Na2CO3溶液中滴加“过滤1”的滤液,并充分搅拌
C “过滤1”的滤液和Na2CO3溶液同时加入,并充分搅拌
-
软锰矿的主要成分是MnO2,还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2,还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金属离子的浓度小于1×10-6视为沉淀完全。)
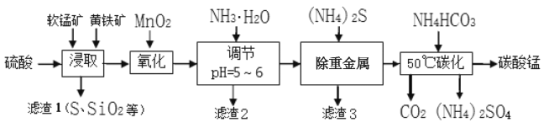
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③_________________等。
(2)流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为_________________。
(3)“滤渣2”中主要成分的化学式为_________________。
(4)流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸锰,该反应的化学方程式为_________________。
(6)生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是_________________。
-
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
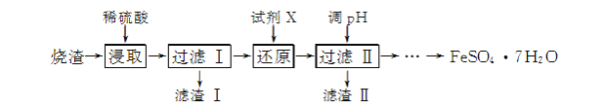
(1) 滤渣Ⅰ的主要成分是________(填化学式),滤渣Ⅱ的主要成分是________(填化学式)。
(2) 试剂X常选用SO2,写出“还原”过程中发生反应的离子方程式:________。
(3) 从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是蒸发浓缩、________、过滤、洗涤、干燥。
(4) FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取8片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤b:取上述溶液25 mL于锥形瓶中,加入少量硫酸酸化,逐渐滴加0.010 0 mol·L-1的KMnO4溶液,反应为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00 mL。
① 步骤a中配制250 mL溶液需要的玻璃仪器有烧杯、玻璃棒、________、胶头滴管。
② 该补血剂中亚铁离子的含量为________mg/片(请写出计算过程)。
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:
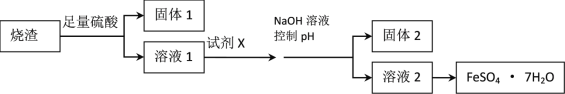
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:
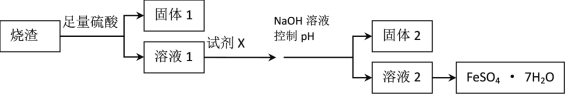
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:

(1)固体1中一定含有的物质是 (填化学式)。
(2)试剂X选用 ,写出试剂X与溶液1反应的离子方程式 。
(3)从溶液2中获得FeSO4•7H2O晶体的实验操作是蒸发浓缩、 、 、洗涤、干燥。
-
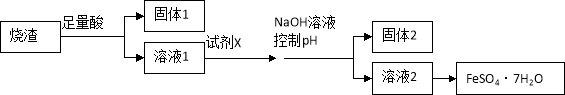
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程
下列说法不正确的是 ( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
-
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:
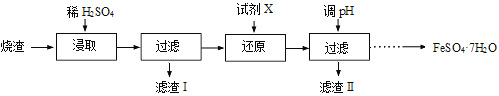
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
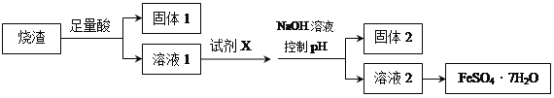
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O

_______________________________________________;
mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)