-
硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含SiO2、A12O3、少量Fe2O3 等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]的实验流程如图所示。
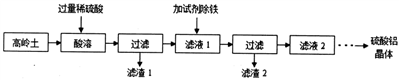
回答以下问题
(1)高岭土需进行粉粹,粉粹的目的是_____________________。
(2)滤渣1经过处理可作为制备水玻璃(Na2SiO3水溶液)的原料,写出滤渣1与烧碱溶液反应的化学方程式____________________________________。
(3)加入试剂除铁前,滤液1中的阳离子除了Al3+、Fe3+外还有的阳离子是__________(填离子符号)。滤渣2主要成分为Fe(OH)3,由于条件控制不当,常使Fe(OH)3 中混有Al(OH)3影响其回收利用,用离子方程式表示除去A1(OH)3的原理____________________________________________。
(4)检验滤液2中是否含有Fe3+的实验方法是(要求写出实验步骤和现象):__________________。
(5)要从滤液2获取硫酸铝晶体需要经过多步处理,其中从溶液中得到晶体的方法是__________(填标号)。
a.蒸发结晶 b.蒸发浓缩、冷却结晶
(6)某兴趣小组为了测定晶体中Al2(SO4)3·18H2O(M=666g·mol-1)的质量分数,进行如下实验:
①准确称取l.00g晶体样品,溶于一定量水中;
②滴入0.100 mol·L-1 EDTA溶液,与Al3+反应所消耗EDTA溶液的体积25.00 mL。 (已知:EDTA与Al3+以物质的量之比1∶1反应,假设杂质不与EDTA反应)则晶体中Al2(SO4)3·18H2O的质量分数是__________;若样品中的杂质离子能与EDTA反应,所测定质量分数将会__________(填“偏高”、“偏低”或“无影响”)。
-
氯化铵简称“氯铵”,又称卤砂,为无色晶体或白色结晶性粉末,易溶于水中,在工农业生产中用途广泛。以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
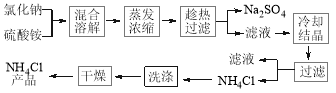
氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题:

(1)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(2)实验过程中趁热过滤的目的是 。
(3)写出“蒸发浓缩”时发生的化学方程式: 。
(4)某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。
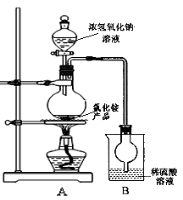
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是: ____ 。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液的离子反应方程式为 ,反应过程中NaOH一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.0gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
-
(12分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。
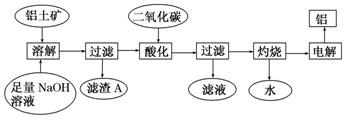
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式,滤渣A的主要成分为________。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为_______________________。
(3)电解氧化铝,每生成1molAl时,生成________ g氧气。
-
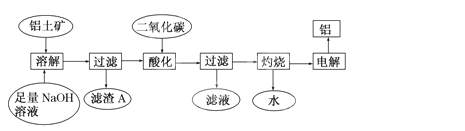
(8分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式________,滤渣A的主要成分为________。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为_______________________。
(3)电解氧化铝,每生成1molAl时,生成________ g氧气。
-
(14分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
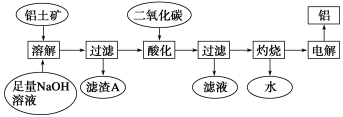
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②除硅的方法:溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
回答下列问题:
(1)Al元素在元素周期表中的位置为 ;电解制取Al的化学反应中,反应物总能量 生成物总能量(填“大于”、“等于”或“小于”);二氧化碳的结构式为 。
(2)写出向Al2O3与氢氧化钠溶液发生反应的离子方程式 _____。
(3)滤渣A的主要成分为__________________________。
(4)在工艺流程第三步中,通入过量二氧化碳的化学反应方程式是_______________________。
(5)实验时取铝土矿ag,经过上述工艺流程最后得到bgAl,则铝土矿中的Al2O3质量分数为 。
A.=102b/54a B.>102b/54a C.<102b/54a D.均有可能
-
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:

已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(1) 写出向铝土矿中加入足量氢氧化钠溶液操作中发生反应的离子方程式:__________________________;_____________________________。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是:_________。
(3)若将铝溶解,下列试剂中最好选用________(填编号)。理由是_________________。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.浓硝酸
-
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
________________________________________________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是______,理由是________________________________________________________________________,
写出酸化过程发生反应的化学方程式________________________________________________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为______________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是________(填化学式),请判断该同学设计的实验方案的合理性________(填“合理”或“不合理”)。原因是_____________________________(若合理,则不用填写)。
-
铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___________________________________________。
(2)“过滤Ⅰ”中所用到的玻璃仪器有___________________________________________。
(3)“过滤Ⅱ”中得到的固体中混有杂质,需要对沉淀进行洗涤,请你叙述如何洗涤?_______。
-
铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:

(1)滤液A加过量NaOH离子方程式表示为____________________;
(2)灼烧时盛放药品的仪器名称是____________________。
(3)步骤IV中发生反应的化学方程式是 。
(4)步骤Ⅲ中生成固体C的离子反应方程式为____________________。
(5)取滤液B 100 mL,加入1 mol·L-1盐酸200 mL,沉淀量达到最大且质量为11.7 g。则滤液B中c(AlO)= , c(Na+)________6 mol·L-1(填“>”、“=”或“<”)。
-
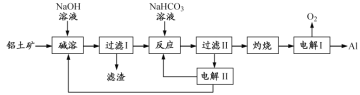
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中应用日趋广泛。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3杂质,SiO2在“碱溶”时转化为铝硅酸钠沉淀)为原料制备铝的一种工艺流程如下:

(1)“过滤Ⅰ”时滤渣的主要成分为 ______________ 、______________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为____________________________。
(3)“反应”时,也可以用NaHCO3代替CO2,写出加入NaHCO3溶液后的离子方程式________________。
(4)“电解”时加入冰晶石的作用是___________________________________。
(5)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气存在下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②1mol镁铝合金(Mg17Al12)分别与足量的盐酸、氢氧化钠溶液充分反应,生成的氢气在相同条件下的体积比为________________。











