-
(14分)研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义。
(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为____________。
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是:_________________。
(2)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
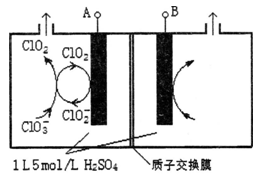
①电源负极为_______极(填A或B):
②写出阴极室发生反应依次为:______________________、______________________;
(3)已知:
2SO2(g)+ O2 (g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g)  SO3 (g) +NO(g)的△H = kJ·mol-1
SO3 (g) +NO(g)的△H = kJ·mol-1
一定条件下,将体积比为1:2的NO2(g)、 SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
-
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为 。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
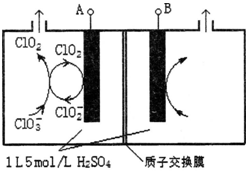
①电源负极为 极(填A或B):
②写出阴极室发生反应依次为: 、
;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为 。
-
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___________________________;向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
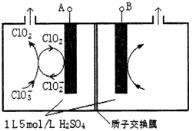
①电源负极为___________________极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式
_______________________ ___ ; 。
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2—歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为_________________。
-
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的绿色消毒剂,纯ClO2易分解爆炸,其一种生产工艺如下,回答下列问题:
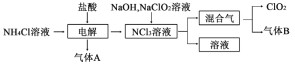
(1)气体A的名称为___________________,NCl3的电子式为_________。
(2)“电解”过程中生成的氧化产物与还原产物的物质的量之比为________。
(3)气体B能使石蕊试液显蓝色,写出NaClO2溶液和NCl3溶液在碱性条件下生成“混合气”的化学方程式____________。
(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。C1O2和C12在消毒时自身均被还原为Cl-,则C1O2的消毒效率是Cl2的__________倍。
(5)科学家又研究出了一种新的制备C1O2的方法,反应原理如下:H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O。此法提高了生产及储存、运输的安全性,原因是_____________________。若反应中转移1mol电子,则生成C1O2 ______ g。
-
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(1)氯元素的原子结构示意图为______.
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物.制备ClO2的方法有以下两种:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O…①
2NaClO2+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O …②
你认为哪种方法最佳______(填序号),理由是______.
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
______ Cl2↑+H2↑+2OH-
-
ClO2是一种国际公认的高效含氯消毒剂,ClO2属于
A. 混合物 B. 酸 C. 碱 D. 氧化物
-
70年代开始发现氯气应用水消毒会产生具有致癌作用的卤代甲烷类化合物。氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广泛消毒剂,是一种黄绿色的气体,易溶于水。我国从2000年起已逐步用消毒剂ClO2代替氯气对饮用水进行消毒。
(1)ClO2消毒水时,可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO-2含量应不超过0.2mg/L。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是_____________(填化学式)。
ClO2在杀菌消毒的同时,可将剧毒氰化物中碳、氮元素氧化成无毒气体而除去,写出用ClO2氧化除去NaCN的化学方程式___________________________________。
(2)①工业上制备ClO2,可以通过NaClO3在H2SO4存在的条件下与Na2SO3反应制得。
请写出该反应的离子方程式:_________________________________________。
②实验室制备ClO2,可以用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料在一定条件下制得,只是制得的ClO2中混有NH3除去ClO2中的NH3可选用的试剂是____;(填序号)
A.浓硫酸 B.饱和食盐水
C.碱石灰 D.水
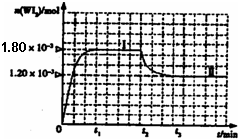
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-===2I—+S4O62—),共用去V ml硫代硫酸钠溶液。
①装置中玻璃液封管的作用是__________________;
②滴定终点的现象是:_________________________。
-
近年来雾霾天气经常出现,研究雾霾成因和治理是当前环保的重要话题。汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1)①对于2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-665kJ/mol的反应分三步完成:
a:2NO(g)=N2O2(g)(快)
b:N2O2(g)+H2(g)=N2O(g)+H2O(g)(慢)
c:N2O(g)+H2(g)=N2(g)+H2O(g)(快)
决定此总反应速率的是第步的反应___(填序号)。
②已知:H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ/mol
汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:___。
(2)升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g)+O2(g)=2NO2(g) △H<0存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k(代表反应速率的一个常数)的数值如表:
| T(K) | k | T(K) | k | T(K) | k |
| 143 | 1.48×105 | 273 | 1.04×104 | 514 | 3.00×103 |
| 195 | 2.58×104 | 333 | 5.50×103 | 613 | 2.80×103 |
| 254 | 1.30×104 | 414 | 4.00×103 | 663 | 2.50×103 |
由实验数据测到v正与c(O2)的关系如图1所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___点(填字母),并解析原因:
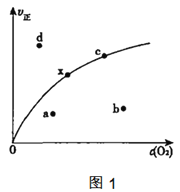
①___
②___
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人得出用活性炭对NOx进行吸收,发生如下反应:
反应a:C(s)+2NO(g)⇌N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)⇌N2(g)+2CO2(g) △H=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0〜10min内,NO的平均反应速率v(NO)=___,当升高反应温度,该反应的平衡常数K___(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)实验室模拟反应2C(s)+2NO2(g)=N2(g)+2CO2(g) △H=-64.2kJ/mol,在密闭容器中加入一定量的碳和NO2,维持温度是T2℃,如图2为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。
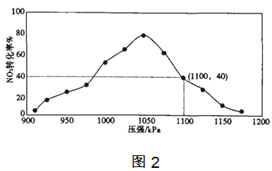
①请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因___;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数___(用计算表达式表示,不必化简);已知:气体分压(p分)=气体总压(p总)×体积分数。
-
十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
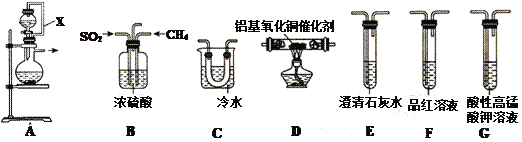
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 . 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
-
氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。回答下列问题:
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
写出NO与臭氧(O3)反应生成NO2的热化学方程式______________________。
(2)温度为T1时,在三个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
实验测得:v正=v(NO)消耗= 2v(O2) 消耗= k正c2(NO)·c(O2),v逆=v(NO2) 消耗= k逆c2 (NO2),k正、k逆为速率常数,受温度影响。
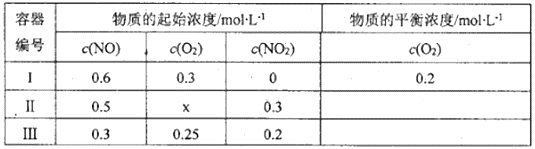
①温度为T1时, k正/k逆=___________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m___________n(填“>”、“<“或“=”)。
②若容器Ⅱ中达到平衡时 c(NO2)/c(NO)=1,则NO的转化率为___________,x=___________。
③容器Ⅲ中起始时v正___________v逆(填“>”、“<”或“=”),理由是___________。
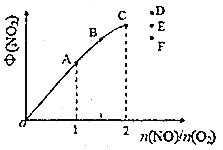
④T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随n(NO)/n(O2)的变化如图所示,则A、B、C三点中NO的转化率最大的是___________;当n(NO)/n(O2)=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的___________。

2SO3 (g) △H =-196.6kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
SO3 (g) +NO(g)的△H = kJ·mol-1








 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
