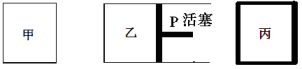-
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应: N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 |
| N2 | H2 | NH3 |
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是 ( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
-
(16分)(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g) △H=―92.4 kJ·mol-1。
2NH3(g) △H=―92.4 kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q 184.8 kJ(填“>”、“<”或“=”)。
②已知:

1mol N—H键断裂吸收的能量为 kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,该温度下反应的平衡常数K = 。欲增大氮气的平衡转化率,可采取的措施有 (写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
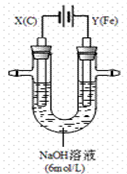
① 电解过程中,X极区溶液的pH (填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-== FeO42-+4H2O和 。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn == Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为 。
-
已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表:
2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表:
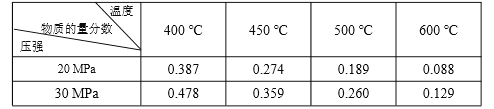
下列说法正确的是
A. 体系中 NH3 的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2 和 H2 的转化率之比均为 1
C. 反应达到平衡时,放出的热量均为 92.4 kJ
D. 600 ℃,30 MPa 下反应达到平衡时,生成 NH3 的物质的量最多
-
已知合成氨反应的物质的量数据如下:
| N2 + 3H2  2NH3 2NH3 |
| 起始物质的量mol | 1.0 | 3.0 | 0 |
| 2秒末物质的量mol | 0.6 | 1.8 | 0.8 |
反应在2L容器中进行,当用氢气浓度的减少来表示该化学反应速率时,其速率为( )
A、0.2 mol/(L·s) B、0.3 mol/(L·s) C、0.6 mol/(L·s) D、0.8 mol/(L·s)
-
已知合成氨反应的浓度数据如下:
| N2 + 3H2  2NH3 2NH3 |
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | 0.8 |
| | | |
当用氨气浓度的增加来表示该化学反应速率时,其速率为 ( ).
A. 0.2 mol/(L·s) B. 0.4 mol/(L·s) C. 0.6 mol/(L·s) D. 0.8 mol/(L·s)
-
相同温度下,在体积相等的三个密闭容器甲、乙、丙中发生可逆反应:N2(g)+ 3H2(g) 2NH3(g) △H=-92.4 kJ/mol。其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=-92.4 kJ/mol。其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:
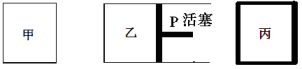
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 |
| N2 | H2 | NH3 |
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| | | | |
下列叙述正确的是
A.N2的转化率:丙是甲的二倍
B.三个容器内反应的平衡常数:甲=乙>丙
C.达平衡时氨气的体积分数:甲>乙>丙
D.放出热量关系: b < a < 92.4
-
已知H—H键键能为436 kJ/mol,H-N键键能为391 kJ/mol。根据热化学方程式3H2(g)+N2(g)= 2NH3(g) △H=-92.4kJ/mol,则N≡N键的键能是 ( )
A. 431.4 kJ/mol B. 945.6 kJ/mol
C. 649.6 kJ/mol D. 896.6 kJ/mol
-
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:
N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
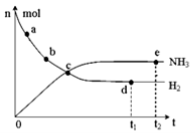
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止
-
在一定条件下N2 + 3H2⇌ 2NH3 的反应中,起始N2浓度为2mol/L,H2浓度为5mol/L, 反应到2分钟时,测得 NH3 的反应速率为v(NH3 )=0.4mol/(L·min),填空:
(1) NH3 的转化浓度为c(NH3 )=___________ mol/(L·min)
(2)三段式填空:
(mol/L) N2 + 3H2 ⇌ 2NH3
起始浓度 2 5 0
转化浓度 _ _ _
2min后浓度 _ _ _
(3)用v(N2)表示的反应速率为:v(N2)=__________mol/(L·min)
(4)用v(H2)表示的反应速率为:v(H2)=__________mol/(L·min)
-
在一个0.5L密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下发生反应N2(g) + 3H2(g)  2NH3(g)。10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
2NH3(g)。10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A.0.1mol·L-1·min-1 B.0.6mol·L-1·min-1
C.0.3mol·L-1·min-1 D.0.2mol·L-1·min-1
2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表: