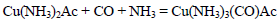-
合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
| 时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
| n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
| n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
| n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______(填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______。
(2)合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
| 化学键 | H—H | N≡N | N—H |
| E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=_______kJ/mol,低温下,合成氨反应_______(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H = _______kJ/mol
2NO(g) △H = _______kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。
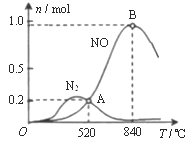
该催化剂在较低温度时主要选择反应_______(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______(只列算式不计算)。
-
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):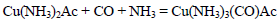
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 。
(2)写出基态Cu+的核外电子排布式 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 。
(4)写出与CO互为等电子体的离子 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为 ;1 mol尿素分子中,σ键的数目为 。
-
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):
Cu(NH3)2Ac + CO + NH3 = Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为▲ 。
(2)写出基态Cu+的核外电子排布式▲ 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为▲ 。
(4)写出与CO互为等电子体的离子▲ 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为▲ ;1 mol尿素分子中,σ键的数目为▲ 。

(6)铜金合金形成的晶胞如上图所示,其中Cu、Au原子个数比为▲ 。
-
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac + CO + NH3⇌Cu(NH3)3(CO)Ac。请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为________。
(2)写出基态Cu+的核外电子排布式_______。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为______。
(4)写出与CO互为等电子体的阴离子______。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],1mol尿素分子中,σ键的数目为______。
(6)已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数比为______。
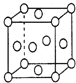
-
(10分)合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:

其中反应②为:4NO+3O2+2H2O 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为▲ 。
-
合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:

其中反应②为:4NO+3O2+2H2O 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为▲ 。
-
氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g)  2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
| 平衡时c(NH3) | c1 | c2 |
| 平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
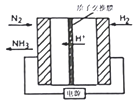
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。
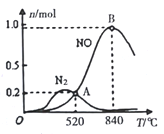
该催化剂在较低温度时主要选择___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为: ,一种工业合成氨,进而合成尿素的简易流程图如下:
,一种工业合成氨,进而合成尿素的简易流程图如下:
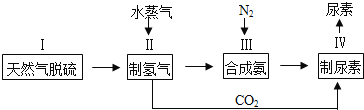
(1)步骤II中制氢气原理如下:


恒容容器中,对于以上反应,能加快反应速率的是______.
 升高温度
升高温度  充入He
充入He  加入催化剂
加入催化剂  降低压强
降低压强
(2)天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
(3) 和
和 在高温、高压、催化剂条件下可合成
在高温、高压、催化剂条件下可合成 ,反应的化学方程式______
,反应的化学方程式______ 以
以 、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
(4)已知
 ,若合成尿素的流程中转化率为
,若合成尿素的流程中转化率为 时,100吨甲烷为原料能够合成______吨尿素.
时,100吨甲烷为原料能够合成______吨尿素.
-
二十世纪初德国化学家哈伯和工程师博施成功地开发了合成氨的生产工艺,为社会的发展和进步做出了重大贡献。如今科学家为提高氨的产量,以及对各种氨的化合物的研究仍做着各种有益的探索。试回答下列问题:
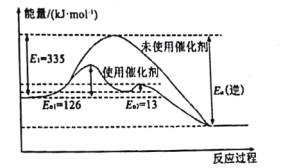
(1)N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
(2)①在一定条件下,分别将lmolN2和3molH2置于容积恒定的密闭容器中,达化学平衡状态时,NH3的体积分数为10%,若保持其他条件不变,起始时改为充入2molN2和2molH2,达新平衡后,NH3的体积分数为___10%(填“>”、“<”或“=”)。
②某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=___(用含p0的代数式表示)。
(3)合成氨需要的H2来源比较广泛,氢气的储存制备等问题也日益得到解决。在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
a.容器内气体压强保持不变
b.吸收ymolH2需1molMHx
c.若向容器内通入少量氢气,新平衡后c(H2)比原平衡大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用现代手持技术传感器可以探究压强对化学平衡移动的影响,如以2NO2(g) N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
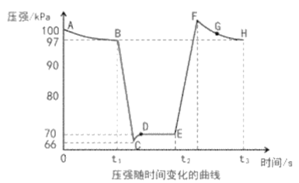
①B、E两点对应的正反应速率大小为vB___vE(填“>”、“<”或“=”)。
②E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(5)NH3能够和Ag+形成Ag(NH3)2+,溶液中存在Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq) Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
-
合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)⇌2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
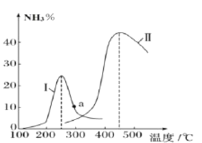
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。
(2)氨气的分解反应2NH3⇌N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
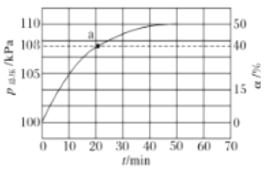
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正•p2(NH3)-K逆•p(N2)•p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的 =__。
=__。
(3)液氨中,2NH3(l)⇌NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的 =____。(已知25℃,Kb(NH3•H2O)=1.810-5;Ka1(H2SO3)=1.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3•H2O)=1.810-5;Ka1(H2SO3)=1.310-2,Ka2(H2SO3)=6.210-8)
2NH3(g) ΔH。
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
4NO(g)+6H2O(g) △H =﹣906kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2NO(g) △H = _______kJ/mol