-
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
反应Ⅰ Ni(S)+4CO(g)
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反应Ⅱ Ni(CO)4(g)  Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有 、 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。
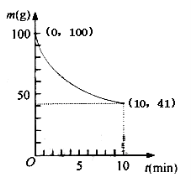
①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。(双选)
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
-
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
步骤(1):Ni(s)+4CO(g) Ni(CO)4(g) △H<0 平衡常数K1
Ni(CO)4(g) △H<0 平衡常数K1
步骤(2):Ni(CO)4(g) Ni(s)+4CO(g) 平衡常数 K2
Ni(s)+4CO(g) 平衡常数 K2
下列说法错误的是( )
A. K1×K2=l
B. 步骤(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡后,CO浓度增大
C. 步骤(1)在低温下易自发进行
D. 该反应达到平衡时,4v生成[Ni(CO)4]=v生成(CO)
-
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g) Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
(2)Ni(CO)4(g)  Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 ________、________ 。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为________ 。
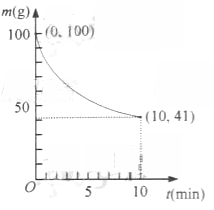
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时________ 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
-
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g) Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
②Ni(CO)4(g) Ni(s)+4CO(g)
Ni(s)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____________、____________ 。
(2)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________ 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(3)简述羰基法提纯粗镍的操作过程____________________________________________。
-
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时, 减小,则H 0(填“>”或“<”)。
减小,则H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。

-
[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电 解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
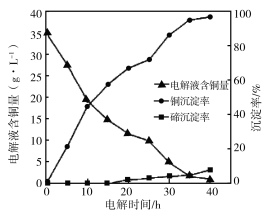
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
-
下列说法正确的是
A.煤的干馏与石油的分馏均属于化学变化
B.硅胶常用作袋装食品的干燥剂
C.含有共价键的化合物一定是共价化合物
D.合金具有许多优良的物理特性,钢是我国最早使用的合金
-
2007年诺贝尔化学奖获得者格格德•埃特尔在表面化学研究领域作出了开拓性贡献.研究气体在固体表面反应的化学已经成为化学科学的一个重要分支,它涉及生产生活中的许多重要领域.下列不属于气体与固体作用的表面化学研究领域的是( )
A.合成氨工业是将氮气和氢气在铁催化剂的表面转化成氨气
B.汽车中装有的催化器,能将尾气中一氧化碳和氮氧化物转化为二氧化碳和氮气
C.在燃料电池中,氢气和氧化剂在催化剂表面反应所产生的能量转化为电能
D.加酶洗衣粉的乳化作用能将衣物纤维表面的油渍洗去
-
尼龙材料是一种性能优良的工程塑料,目前广泛应用于汽车领域,具有优异的力学性能。以A(C6H10)原料通过氧化反应制备G,再通过缩聚反应合成尼龙,合成路线如下:
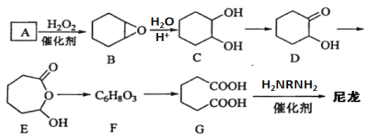
回答下列问题:
(1)A的化学名称为_________________;
(2)B到C的反应类型为_______________;
(3)D中含有的官能团名称是____________;
(4)E的分子式为_____________;
(5)由G合成尼龙的化学方程式为________________________________;
(6)写出一种与C互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积之比为3:1)_____________。
(7)1,4-二溴环己烯( )是多数有机合成一种重要的中间体,设计由B为起始原料制备1,4-二溴环己烯的合成路线____________________。
)是多数有机合成一种重要的中间体,设计由B为起始原料制备1,4-二溴环己烯的合成路线____________________。
-
常压下羰基化法精炼镍是工业上提纯镍的主要方法,其原理为:Ni(s)+4CO(g)  Ni(CO)4(g) △H<0。已知:Ni(CO)4的沸点为42.2℃,230℃时该反应的平衡常数K=2×10—5,固体杂质不参与反应。
Ni(CO)4(g) △H<0。已知:Ni(CO)4的沸点为42.2℃,230℃时该反应的平衡常数K=2×10—5,固体杂质不参与反应。
第一阶段:调控温度使粗镍与CO反应,转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,调控温度制得高纯镍。
下列判断正确的是
A. 第一阶段将粗镍粉碎有利于平衡正向移动
B. 第二阶段可以选择230℃
C. 第一阶段的温度高于第二阶段的温度
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
Ni(CO)4(g)△H1<0
Ni(S)+4CO(g) △H2

Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应

 Ni(s)+4CO(g)
Ni(s)+4CO(g)


