-
铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是____________________。
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为________%。
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是___________________。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是______________________。
-
三氯化铁熔点282 ℃、沸点315 ℃,能吸收空气里的水分而潮解。它可广泛用于污水处理、电子工业、印染业、建筑业,某化学实验小组的同学欲用下列仪器制备FeCl3固体。
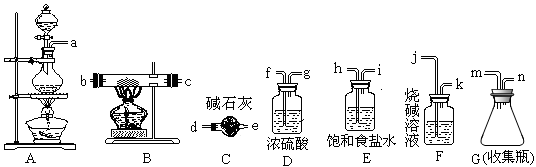
(1)写出制备氯气时的离子方程式_______________________
(2)所选用的仪器连接顺序(填写接口字母)为___________n→d__________
(3)实验过程中,给A、B仪器加热的顺序为_____________________,这样操作的目的是_______________,可作为点燃B处酒精灯的实验标志是_________________;若C可以用D代替,则使用C的目的是______________________。若缺少此类装置,此B中可能发生的另一个反应的方程式为________________________。
(4)有同学认为,若不使用E装置,则B中会有FeCl2生成,请设计一个实验确定此观点是否正确________________________________________________________________。
-
已知三氯化铁的熔点为 ,沸点为
,沸点为 ,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:

(1)装碱石灰的仪器是_________(填仪器名称)。
(2)装置的连接顺序为____________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①固体混合物的成分是____________。(填化学式)
②淡黄色溶液中加入试剂X 生成淡红色溶液的离子反应方程式为________。
(4)已知红色褪去的同时有气体生成,经检验为 。该小组内的同学们对红色褪去的原因提出了三种假设。
。该小组内的同学们对红色褪去的原因提出了三种假设。
假设Ⅰ: 还原
还原 ,使其转变为
,使其转变为 ;
;
假设Ⅱ: 分解生成
分解生成 ,
, 氧化试剂X;
氧化试剂X;
假设Ⅲ:_______。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和 溶液,产生白色沉淀。
溶液,产生白色沉淀。
②另取同浓度的  溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入 ,无明显变化。实验①说明假设__________不正确;由实验①②得出假设________是正确的。
,无明显变化。实验①说明假设__________不正确;由实验①②得出假设________是正确的。
-
四氯化锡(SnCl4)是一种重要的化工产品,可在加热下直接氯化来制备。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
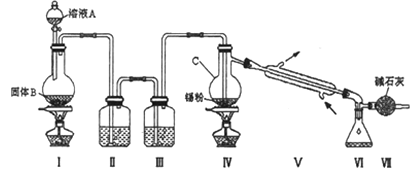
(1)装置Ⅰ中发生反应的离子方程式为________;
(2)装置Ⅱ中的最佳试剂为_______,装置Ⅶ的作用为_______;
(3)该装置存在的缺陷是:_______________;
(4)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为_______________;
(5)实验用锡粒中含有杂质Cu.某同学设计下列实验测定锡粒的纯度.
第一步:称取0.613g锡粒溶入足量盐酸中,过滤;
第二步:向滤液中加入过量FeCl3溶液,将Sn2+氧化成Sn4+;
第三步:用0.100 mol•L-1 K2Cr2O7溶液滴定生成的Fe2+,发生反应的表达式为(未配平):Fe2+ + Cr2O72- + H+→Cr3+ + Fe3+ + H2O
第二步中发生反应的离子方程式是 _______________,若达到滴定终点时共消耗16.0 mLK2Cr2O7溶液,试写出试样中锡的质量分数的计算式____________(仅写计算结果,锡的相对原子质量按119计算)
-
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 | 色态 | 挥发性 | 熔点 | 沸点 |
| 金黄色液体 | 易挥发 | -76℃ | 138℃ |
| 化学性质 | 300 ℃以上完全分解 |
| S2Cl2+Cl2 2SCl2 2SCl2 |
| 遇水反应生成SO2、S等产物 |
向熔融的硫中通以干燥、纯净的C12即可生成S2C12。下图是实验室制备S2Cl2的装置。
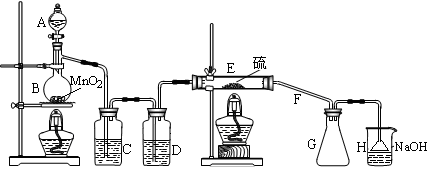
(1)仪器A的名称是________,导管F除导气外还起的作用是________;
(2)B中反应的离子方程式为________;
(3)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分
液漏斗活塞没有堵塞,你认为应采取的措施是________;
(4)装置C中的试剂是________;如果缺少D装置,则对实验的影响是(用化学方程式表示)________;
(5)如果在加热E时温度过高,对实验结果的影响是________;为了提高S2C12的纯度,关键的操作是控制好温度和________。
(6)设计装置H的目的是________;烧杯中发生反应的离子方程式
是________。
-
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ |
| 化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 2SCl2 2SCl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 |
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
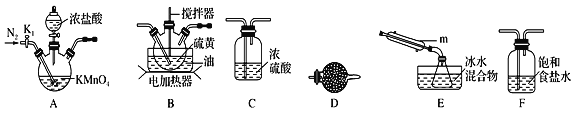
①仪器m的名称为__,装置F中的试剂作用是__。
②装置连接顺序:__→__→__→__→__→D。__
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是__。
④为了提高S2Cl2的纯度,实验的关键是__。(写两点)
(2)S2Cl2有剧毒,少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散)。S2Cl2遇水会生成SO2、HCl两种气体,写出该反应的化学方程式__。
(3)某同学设计了如下实验方案来测定S2Cl2与水反应后的混合气体中SO2的体积分数。

①W溶液可以是__(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__(用含V、m的式子表示)。
-
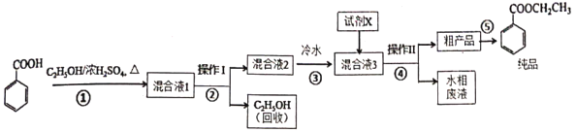
苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
试剂相关性质如下表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 常温颜色状态 | 白色针状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为________。
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是________________;仪器C中反应液应采用________方式加热。
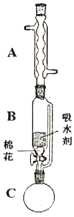
⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为________。
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是____;操作Ⅱ所用的玻璃仪器除了烧杯外还有_____。
⑸向混合液3中加入的试剂X为________(填写化学式)。
⑹最终得到产物纯品12.0g,实验产率为________%(保留三位有效数字)。
-
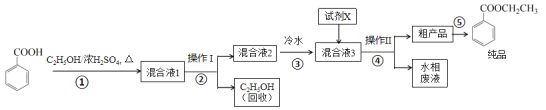
苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
试剂相关性质如下表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
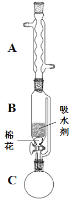
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。
-
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:

(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ________mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
( 已知:2Fe3+ +2I-= I2 +2Fe2+ I2+2S2O32-=2I- +S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为__________________。
-
三氯化碘(ICl3 ,I的化合价为+3价)在药物合成中用途非常广泛,其熔点:33℃,沸点73℃。实验室可用如图装置制取ICl3。

(1)试剂X、Y分别是: 、 。装置E的作用是: 。
(2)制备氯气选用的药品为漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为: 。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:  。
。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
(5)某同学欲测定ICl3样品中ICl3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI=2I2+3KCl(样品中杂质不反应)。将所得溶液配置成100mL待测液。取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2 S2O32--=2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为: 。重复滴定3次,测得消耗Na2S2O3溶液体积的平均值为20.00mL。该样品中ICl3的质量分数为: 。(ICl3相对分子质量为233.5)













