-
硫、碳、氮等是重要的非金属元素。请回答下列有关问题:
(1)H2S广泛存在于化石燃料中,因此H2S的吸收和利用是化石燃料化工中的一项重要任务。
①H2S可用NaClO溶液吸收,吸收后的溶液既能使AgNO3溶液生成白色沉淀,也能使Ba(NO3)2 溶液生成白色沉淀,则H2S用过量NaClO溶液吸收的离子方程式为_______________________。
②利用多硫化物(如Na2Sx)吸收H2S,其吸收原理可用以下四步反应表示:
ⅰ.H2S+OH-=HS-+H2O; ⅱ.2HS- H2↑+S22-;
H2↑+S22-;
ⅲ.H2S+S22-=2HS-+S↓; ⅳ.HS-+H2O=H2S+OH-。
四步反应的总反应中的生成物是_______,在总反应中,多硫化物的作用是_____________。
(2)25℃时,H2CO3、NH3•H2O在水中的电离平衡常数如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离常数 | Ka1=4.0×l0-7 Ka2=5.0×l0-11 | Kb=2.0×10-5 |
①判断0.1 mol•L-1的(NH4)2CO3溶液呈_______性(填“酸”“中”或“碱”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度由大到小的顺序为______________。
②0.50 mol • L-1的Na2CO3溶液的pH=_______(忽略CO32-第二步水解和H2O的电离)。
③25℃时,Mg(OH)2的Ksp=2.0×10-11,要使0.002 mol•L-1的MgSO4溶液中生成Mg(OH)2沉淀,应调整溶液pH不低于________。
-
碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 •2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g •L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ• mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ• mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g)  CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
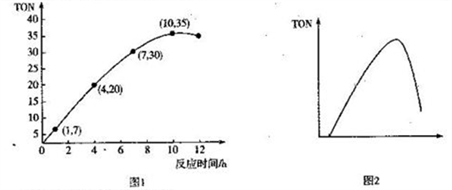
已知:TON=
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
| 弱酸 | 碳酸 | 次氯酸 |
| 电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol • L-1 NaClO 溶液的 pH=________________。
-
煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO, 主要反应为①C(s)+CO2(g) 2CO(g) △H
2CO(g) △H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s) 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g) K2O(s)+CO(g) △H2=-98.4 k/mol
K2O(s)+CO(g) △H2=-98.4 k/mol
④K2O(s)+CO2(g) K2CO3(s) △H3=-456.0 kJ/mol
K2CO3(s) △H3=-456.0 kJ/mol
(1) △H=_____________。

(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图像回答问题:
①若在温度为900℃,压强为P的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________,判断理由是_______________。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________。
(3) 化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________(填序号) 。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
-
H2S作为一种有毒气体,广泛存在于石油、化工、冶金、天然气等行业的废气中,脱除气体中的硫化氢对于保护环境、合理利用资源都有着现实而重要的意义。
请回答下列问题:
(1)H2S的电子式为____________,其热稳定性弱于HCl的原因是____________。
(2)用H2S和天然气生产CS2的反应为CH4(g)+2H2S(g)  CS2(l)+4H2(g)。
CS2(l)+4H2(g)。
已知:I.CH4(g)+4S(s)  CS2(g)+2H2S(g) △H1=akJ·mol-1;
CS2(g)+2H2S(g) △H1=akJ·mol-1;
II.S(s)+H2(g)  H2S(g) △H2=bkJ·mol-1;
H2S(g) △H2=bkJ·mol-1;
Ⅲ.CS2(1)  CS2(g) △H3=ckJ·mol-1;
CS2(g) △H3=ckJ·mol-1;
则反应CH4(g)+2H2S(g)  CS2(1)+4H2(g)的△H=____________ kJ·mol-1(用含a、b、c的代数式表示)。
CS2(1)+4H2(g)的△H=____________ kJ·mol-1(用含a、b、c的代数式表示)。
(3)800℃时,将一定量的H2S气体充入恒容密闭容器中,发生反应H2S(g)  S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度_______mol/L,该温度下,反应的化学平衡常数K=______。
S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度_______mol/L,该温度下,反应的化学平衡常数K=______。
(4)向恒压密闭容器中充入0.1 molCH4和0.2molH2S,发生反应CH4(g)+2H2S(g)  CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
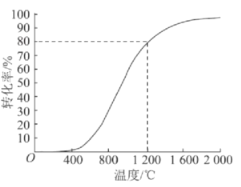
①该反应的活化能:E正____________E逆(填“>”“<”或“=”)
②若初始容积为V0L,1200℃反应达到平衡时,容器的容积为____________L(用含V0的代数式表示)。
③1200℃时,欲提高CH4的平衡转化率,可以采取的措施是____________(填选项字母)。
A.增大压强 B.再充入CH4
C.再充入H2S D.充入He E.使用高效催化剂
(5)H2S废气可用碳酸钠溶液吸收,将吸收足量H2S气体后的溶液加入到如图所示的电解池中进行电解,在阳极生成有工业价值的Na2S2O3,电解时阳极的电极反应式为____________。

-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:

① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K (填“增大”、“减小”或“不变”)
-
硼、磷元素在化学中有很重要的地位,硼、磷及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。回答下列问题。
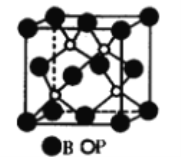
(1)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图是磷化硼晶体的晶胞示意图,则磷化硼的化学式为_____,该晶体的晶体类型是_______。
(2)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如下图]。
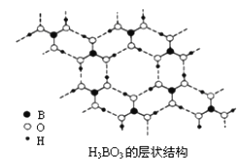
①硼酸分子中B最外层有_______个电子,1molH3BO3的晶体中有_______mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为____________元酸,[B(OH)4]-含有的化学键类型为________。
(3)四(三苯基膦)钯分子结构如图:
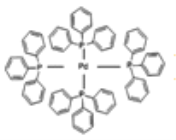
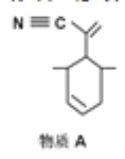
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为_____;判断该物质在水中溶解度并加以解释________。该物质可用于如图所示物质A的含成。物质A中碳原子杂化轨道类型有_______个;一个A分子中手性碳原子数目为_____。
(4)在图示中表示出四(三苯基膦)钯分子中配位键____________
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距高最近的两个阳离子核间的距离为_______(用合有a的代数式表示)。在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_______g(氧离子的半径为1.40×10-10m,令 ≈l.7)。
≈l.7)。
-
化学与生活、技术密不可分,下列有关说法错误的是
A. 天然气是高效清洁的化石燃料 B. 可利用离子反应处理水中的微量重金属元素
C. 油脂可以制取肥皂 D. 我国使用最早的合金是生铁
-
[化学-选修3:物质结构与性质]
硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________。
(2)①硫单质的一种结构为 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 _______A1F3(填“>”或“<”),原因是___________________。
②分析并比较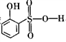 与
与 的沸点高低:___________________。
的沸点高低:___________________。
(4)ZnS晶胞如图所示:

①由图可知,Zn2+填在了S2-形成的______________空隙中。
②已知晶胞密度为, g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
-
[化学-选修3:物质结构与性质]
硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________。
(2)①硫单质的一种结构为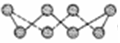 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 _______A1F3(填“>”或“<”),原因是___________________。
②分析并比较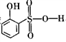 与
与 的沸点高低:___________________。
的沸点高低:___________________。
(4)ZnS晶胞如图所示:
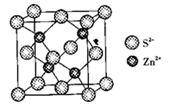
①由图可知,Zn2+填在了S2-形成的______________空隙中。
②已知晶胞密度为, g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
-
锂离子电池应用十分广泛,从废旧钻酸锂(LiCoO2)锂离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题。现欲利用图19所示的工艺流程回收废旧电池中的某些金属资源(部分条件未给出)。回答下列问题:
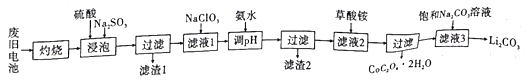
已知:①滤液1中阳离子有H+、Co2+、Fe2+、Al3+、Li+等;
②两种物质不同温度下的溶解度如下表所示:
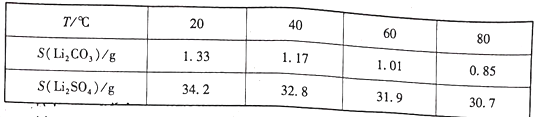
(1)钴酸锂( LiCoO2)钴元素的化合价为___________。
(2)浸泡时加入Na2SO3的主要目的是______________________;可用盐酸代替H2SO4和Na2SO3的混合液,但缺点是______________________。
(3)滤液1中加入NaClO3的主要目的是______________________(用离子方程式表示)。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mo·L-1时已沉淀完全)加入氨水调节pH的最小值是___________。(已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,1g3=0.52)
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是___________。
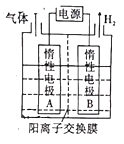
(6)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,利用如图所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为___________(填化学式)溶液;阳极电极反应式为______________________;电解过程中Li+向___________(填“A”或“B”)电极迁移。
H2↑+S22-;










 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。 与
与
 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。 与
与


