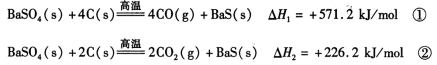-
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得BaSO4(s) + 4C(s)  4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收得到硫化钠。一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是 (填序号)
A.硫化钠在水溶液中水解生成了NaOH和H2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO2而放出H2S气体
(2)向同物质的量浓度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成 沉淀,当 = 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且 会 (填变大、变小、始终不变)。[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
会 (填变大、变小、始终不变)。[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)  2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
-
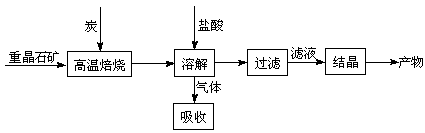
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)  2CO(g)的△H= ________kJ·mol-1。
2CO(g)的△H= ________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是________。
-
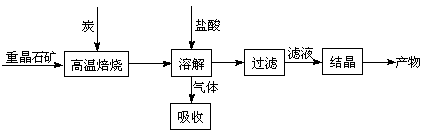
(7分)工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =________。
=________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= ________kJ·mol-1。
2CO(g)的△H2= ________kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是________,________。
-
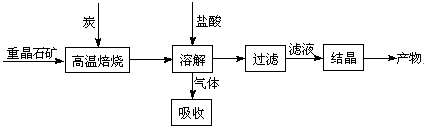
(6分)工业上制备BaCl2的工艺流程图如下:
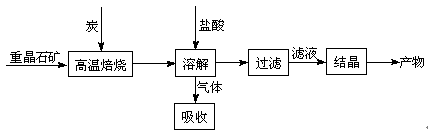
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
-
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为______.
(2)反应C(s)+CO2(g) 2CO(g)的△H2=______kJ•mol-1.
2CO(g)的△H2=______kJ•mol-1.
(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
①下列措施中,有利于降低大气中CO2浓度的有:______.(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O C6H12O6 b.CO2+3H2
C6H12O6 b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH d.2CO2+6H2
CH3COOH d.2CO2+6H2 CH2═CH2+4H2O
CH2═CH2+4H2O
以上反应中,最节能的是______,原子利用率最高的是______.
-
工业上制备BaCl2的工艺流程图如下:
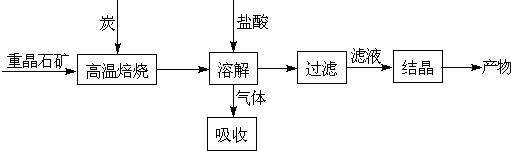
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为______;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =______;[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=______;[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) 2CO(g)的△H2=______kJ•mol-1;
2CO(g)的△H2=______kJ•mol-1;
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______.
-
(11分)工业上制备BaCl2的工艺流程图如图7:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
(1)高温焙烧时常把原料粉碎,目的是_________________________________
(2)常温下,相同浓度的Na2S和NaHS溶液中,说法正确的是:________(3分)
A. Na2S溶液的pH比NaHS溶液pH大
B. 两溶液中含有的离子种类不同
C. 两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D. 两溶液中加入NaOH固体,c(S2-)都增大
E. NaHS溶液中:c(Na+) > c(HS-)> c(OH-) > c(H+) > c(S2-)
(3)反应C(s) + CO2(g) 2CO(g)的△H = ________
2CO(g)的△H = ________
(4)制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:
(5)实际生产中必须加入过量的炭,同时还要通入空气,目的是:________
________ (写出一种原因即可)
-
(10分)工业上制备BaCl2的工艺流程图如图:
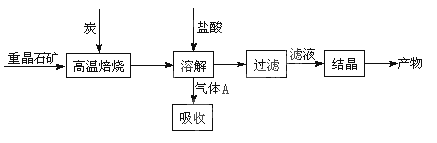
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
A.Na2S溶液的pH比NaHS溶液pH小
B.两溶液中含有的离子种类不同
C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D.两溶液中加入NaOH固体,c(S2-)都增大
E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+)
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)反应C(s) + CO2(g) 2CO(g)的ΔH =
2CO(g)的ΔH =
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
-
工业上制备BaCl2的工艺流程图如图:
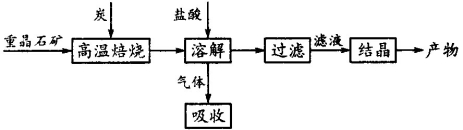
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ________________。
________________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)  2CO(g)的ΔH=____________kJ·mol-1。
2CO(g)的ΔH=____________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
-
工业上制备 BaC12 的工艺流程图如图所示:
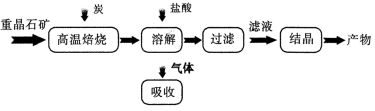
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
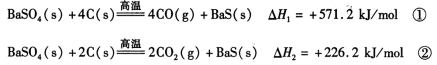
(1)反应C(s) + CO2(g) 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol
(2)过滤过程中需要使用玻璃棒,玻璃棒的作用是 。
(3)盐酸溶解焙烧的固体后,产生的气体用过量 NaOH 溶液吸收,得到硫化钠溶液。 Na2S 水解的离子方程式为 。
(4)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, = 。[已知:
= 。[已知:
Ksp(AgBr) = 5.4×10─13 , Ksp(AgCl) = 2.0×10─10]

4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
会 (填变大、变小、始终不变)。[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
2CO(g)的△H= kJ·mol-1。