-
氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.工业上常通过下列反应制备CuCl:2CuSO4+Na2SO3+2NaCl+Na2CO3═2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4•5H2O与H2O的质量之比.
(2)准确称取所制备的0.250 0g CuCl样品置于一定量的0.5 mol•L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol•L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液.有关反应的离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+通过计算说明上述样品中CuCl的质量分数是否符合标准.高三化学解答题中等难度题查看答案及解析
-
氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.工业上常通过下列反应制备CuCl:2CuSO4+Na2SO3+2NaCl+Na2CO3═2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4•5H2O与H2O的质量之比.
(2)准确称取所制备的0.250 0g CuCl样品置于一定量的0.5 mol•L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol•L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液.有关反应的离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+通过计算说明上述样品中CuCl的质量分数是否符合标准.高三化学解答题中等难度题查看答案及解析
-
氯化亚铜(CuCl)是重要的化工原料。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3→2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为________。
(2)准确称取所配制的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反应的离子方程式为:
Fe3++CuCl→Fe2++Cu2++Cl- Ce4++Fe2+→Fe3++Ce3+
已知国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品中CuCl的质量分数是否符合国家标准。
高三化学计算题简单题查看答案及解析
-
氯化亚铜(CuCl)是重要的化工原料。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3→2CuCl↓+3Na2SO4+CO2↑
⑴ CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为________。
⑵ 准确称取所配制的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反应的离子方程式为:
Fe3++CuCl→Fe2++Cu2++Cl- Ce4++Fe2+→Fe3++Ce3+
已知国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品中CuCl的质量分数是否符合国家标准。
高三化学计算题困难题查看答案及解析
-
氯化亚铜(CuCl)是重要的化工原料。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3→2CuCl↓+3Na2SO4+CO2↑
⑴ CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为________。
⑵ 准确称取所配制的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反应的离子方程式为:
Fe3++CuCl→Fe2++Cu2++Cl- Ce4++Fe2+→Fe3++Ce3+
已知国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品中CuCl的质量分数是否符合国家标准。
高三化学计算题中等难度题查看答案及解析
-
氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业。
(1).工业上氯化亚铜可由下列反应制备:
2CuSO4+ Na2SO3 + 2NaCl + Na2CO3 2CuCl ↓+ 3Na2SO4 + CO2↑。制备过程中需要20% 的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾 g,需要水 g。
(2).实验室可用如下方法制备少量CuCl:取10mL 0.2mol/L CuCl2溶液,加入0.128g铜屑和36.5%的浓盐酸(密度为1.2g/mL)3mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀。
已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036mol、n(Cl–)=0.032mol。请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量。
(3).由CO2、O2、CO、N2组成的混合气体1.008L,测得其密度为1.429g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO) (假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定)。
①该混合气体的摩尔质量是 g/mol;混合气体中n(CO2): n(CO和N2) = 。
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?
高三化学计算题简单题查看答案及解析
-
化学学习活动小组学习了铁铜化合物知识后,查阅资料,积极思考,提出了一系列问题,请予以解答:
(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3=2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式是___________;
(2) 已知:Cu2O在酸溶液中发生歧化反应:Cu2O+2H+=Cu2++Cu +H2O
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子_________________(用离子符号表示);继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化________________(用离子符号表示);不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3 mol电子,该反应的离子方程式是_____________________。
高三化学填空题中等难度题查看答案及解析
-
化学学习活动小组学习了铁铜化合物知识后,查阅资料,积极思考,提出了一系列问题,请予以解答:
(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式是
(2) 已知:Cu2O在酸溶液中发生歧化反应:Cu2O+2H+==Cu2+ +Cu +H2O
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子 (用离子符号表示);继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化 (用离子符号表示);不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3 mol电子,该反应的离子方程式是 。
高三化学填空题中等难度题查看答案及解析
-
氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图.
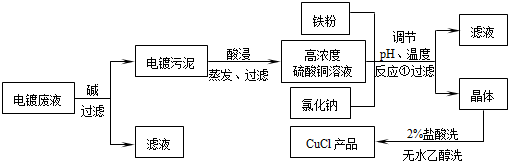
如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.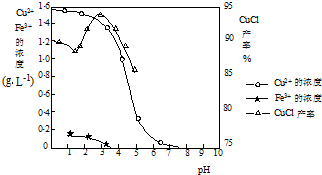
试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:________.
(2)由反应①制备CuCl时的最佳pH在________左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有________的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:________.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:________.高三化学填空题中等难度题查看答案及解析
-
氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图.
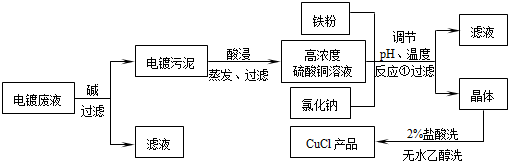
如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.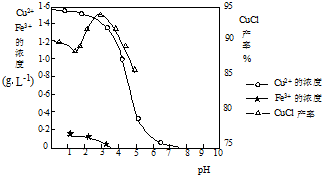
试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:________.
(2)由反应①制备CuCl时的最佳pH在________左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有________的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:________.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:________.高三化学填空题中等难度题查看答案及解析