-
氧化亚铜( Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:

已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______ 左右。
| pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
| 废液含铜量/g. L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17. 0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成 Cu2O的离子方程式为_________;该过程产生的SO2经_____ (填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对 Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:
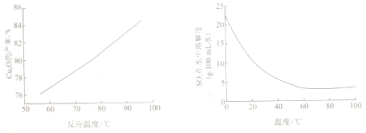
下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120 g·L-1的酸性蚀刻液和V2 L含铜量160 g·L-1的碱性蚀刻液制备Cu2O,最终得到产品m g,产率为____ % 。
-
下列物质的性质描述正确的是
A.Fe在Cl2中燃烧生成FeCl2和FeCl3
B.Na2O2与H2O反应中,Na2O2只作氧化剂
C.FeCl3溶液能与Cu反应,可用蚀刻印刷电路
D.汽车尾气中CO与NO反应生成NO2和CO2
-
在电子工业中,制印刷电路时,常用氯化铁溶液为铜的“腐蚀液”,该过程发生的反应为:2FeCl3+Cu==2FeCl2+CuCl2 , 该反应利用了铜的什么性质
A. 氧化性 B. 还原性 C. 导电性 D. 导热性
-
下列各组离子在碱性条件下可以大量共存,在酸性条件下因发生氧化还原反应而不能大量共存的是( )
A.Cu2+ Fe2+ NO3- Cl– B.K+ Mg2+ HSO3- SO42-
C.S2- Na+ K+ Cl- D.Ba2+ Na+ I- NO3-
-
下列有关物质的性质与应用不相对应的是
A. 明矾能水解生成Al(OH)3 胶体,可用作净水剂
B. FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路
C. SO2 具有氧化性,可用于漂白纸浆
D. Zn 具有还原性和导电性,可用作锌锰干电池的负极材料
-
下列关于铜的说法不正确的是( )
A. 铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2
B. 铜丝在氯气中燃烧生成CuCl2而与硫反应生成Cu2S,说明氧化性Cl2 > S
C. CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气
D. 蓝色的CuSO4·5H2O可以受热分解转化为白色的CuSO4
-
制印刷电路版时常用FeCl3溶液作为“腐蚀液”,如图为反应Cu+2FeCl3=2FeCl2+CuCl2中电子转移的关系图,则图中的元素甲、乙分别表示( )

A.  ,Cl B.
,Cl B.  ,
, C.
C.  ,Cl D.
,Cl D.  ,
,
-
在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu=2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
A.残余固体全部是Cu
B.残余固体可能为Fe和Cu的混合物
C.最后得到的溶液可能含有Fe3+
D.残余固体是Fe,溶液中一定不含Cu2+
-
在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
A.残余固体全部是Cu
B.残余固体可能为Fe和Cu的混合物
C.最后得到的溶液可能含有Fe3+
D.残余固体是Fe,溶液中一定不含Cu2+
-
无论在酸性还是在碱性溶液中,都能大量共存的离子组是( )
A.K+、CO32-、Ag+、SO42-
B.Na+、Cu2+、SO42-、Cl-
C.NO3-、Na+、Cl-、K+
D.Ca2+、K+、CO32-、NO3-


