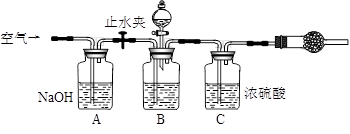-
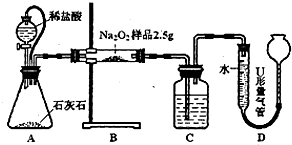
(11分)为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案。
已知:2Na2O2+2CO2=== 2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
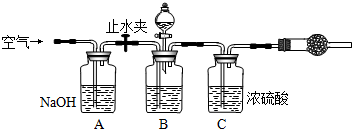
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度。
(1)C中所盛的药品是:________。
(2)A中橡皮管的作用是:。
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是(填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
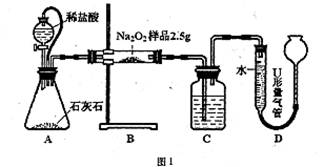
乙:称取3.500 g试样,配成1000.00 mL溶液,用0.1000 mol·L-1的标准盐酸滴定。
(4)取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图________________________,取溶液所用仪器的名称是________________________。
(5)滴定操作平行实验的数据记录如下表:
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
由表中数据计算样品中Na2O2纯度为________________________。
-
为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案.
已知:2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度.
(1)C中所盛的药品是:______.
(2)A中橡皮管的作用是:______.
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是______(填选项字母).
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
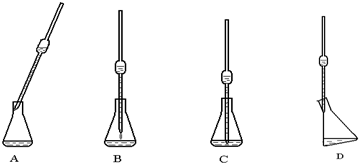
乙:称取3.500g试样,配成1000.00mL溶液,用0.1000mol•L-1的标准盐酸滴定.
(4)取上述所配溶液25.00mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图______,取溶液所用仪器的名称是______.
(5)滴定操作平行实验的数据记录如下表:
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
由表中数据计算样品中Na2O2纯度为______.
-
现有一定量含有Na2O杂质的Na2O2试样,用图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
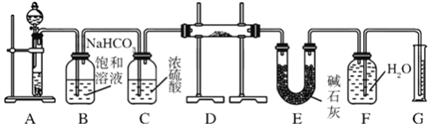
回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是______________,装置E中碱石灰的作用是__________________。
(3)装置D中发生反应的化学方程式是:
_______________________、_______________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
-
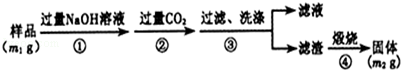
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
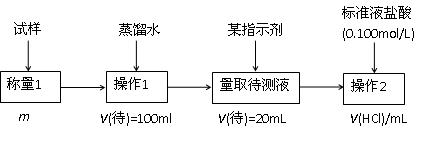
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图:
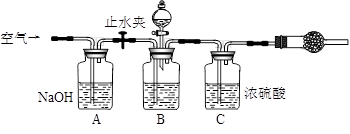
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
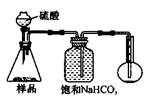
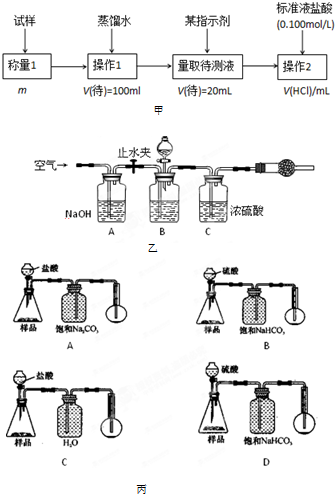
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
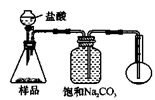
A B
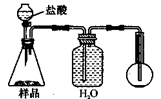
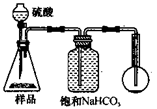
C D
-
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了两种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g.
称量时所需定量实验仪器为______.根据方案一的数据,算出样品中纯碱的质量分数为______(用代数式表示).
(2)方案二的实验装置如图:
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.
根据方案二的数据,算出样品中纯碱的质量分数为______(用代数式表示).图中装置A的作用是______.装置C的作用是______.如果没有装置A和实验操作④⑦,会导致测量结果______(填“偏大”、“偏小”或“无影响”).有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”),改进措施可以是______.
-
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为______.判断是否达到恒重的标准是______.
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有______.
②滴定时选择的指示剂为甲基橙.当溶液______时,说明达到了滴定终点.
③为减少偶然误差,通常的处理办法是______.
④滴定时若锥形瓶内有少量液体溅出,则测定结果______.(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果______.
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为______(用代数式表示).上图中装置A的作用是______.装置C的作用是______.有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”).改进措施可以是______.
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是______.(选填序号)
-
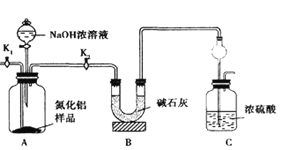
氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
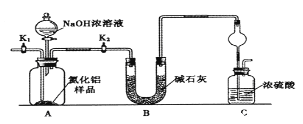
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是____,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
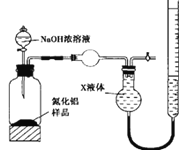
(方案2)用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
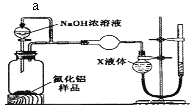
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.
(6)若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为___(用含V、m的代数式表示)。
-
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
(方案l)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)图中球形干燥管的作用是__________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____________。
(3)假设其他操作均正确,按照图装置将导致测定结果_______________(填“偏高”、“偏低”或“无影响”)。
(方案2)用图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体最好选择________________。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.浓硫酸
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况)。则AlN的质量分数是___________________(需化简)。
(方案3)按下列路径测定样品中AlN的纯度:

(6)写出步骤反应的离子方程式_____________________。
(7)该方案能否测出AlN的纯度?(若能请用m1,m2列出计算纯度的表达式)__________。
-
氮化铝(AlN)是一种新型无机非金属材料.某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案.
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
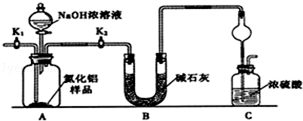
(1)图C装置中球形干燥管的作用是 .
(2)完成以下实验步骤:组装好实验装置,首先进行的操作是 ,再加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是 .
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 .
【方案2】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去).

(4)为测定生成气体的体积,量气装置中的X液体可以是 .
A.CCl4 B.H2O C.NH4Cl溶液 D.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是 .
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为 .
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”).
-
氮化铝(AlN)是一种新型无机非金属材料.某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案.
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(1)(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
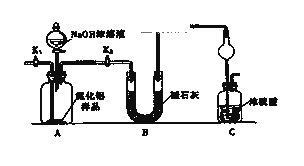
(i)图C装置中球形干燥管的作用是________.
完成以下实验步骤:组装好实验装置,首先进行的操作是________,再加入实验药品.接下来的实验操作是关闭,打开,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1 ,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是________.
(iii)由于装置存在缺陷,导致测定结果偏高,请提出改进意见________.
(2)(方案2)用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去).
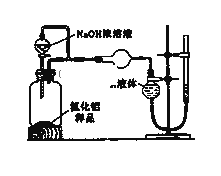
(i)为测定生成气体的体积,量气装置中的X液体可以是________.
A.CCl4 B.H2O C.NH4Cl溶液 D. 
(ii)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是________.
(3)(方案3)按以下步骤测定样品中A1N的纯度:
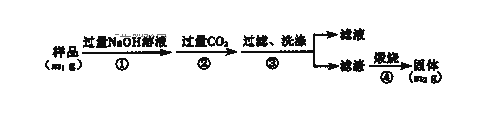
(i)步骤②生成沉淀的离子方程式为________.
(ii)若在步骤③中未洗涤,测定结果将________(填“偏高”、“偏低”或“无影响”).