-
A、B、C、D、E、F为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出D基态原子的价电子排布图__________,F基态原子的外围电子排布式________。
(2)下列说法不正确的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.第一电离能由小到大的顺序:B
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_____区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为_____________(用元素符号表示)。
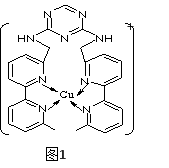
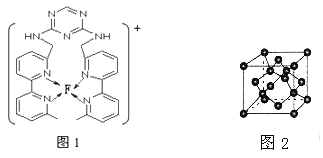
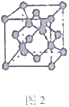
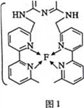
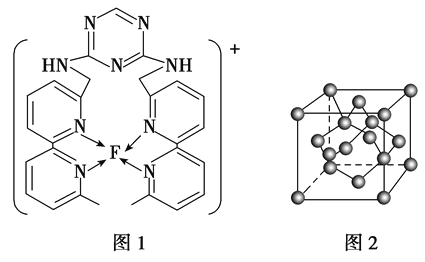
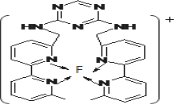
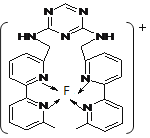
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式为_________。
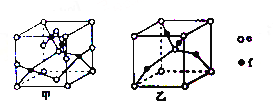
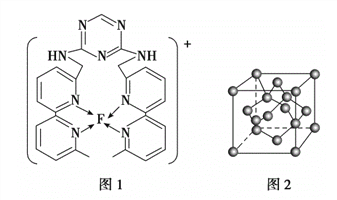
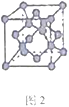
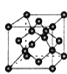
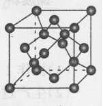
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子的个数为______。
(6)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释与D的简单氢化物结构十分相似的OF2的极性很小的原因是____________。
(7)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm。F离子的半径bpm,则该晶胞的空间利用率为______________。
-
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3) F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为____________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。

-
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法不正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为________________________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
-
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3) F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为____________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。
请回答下列问题:
(1)请写出:D基态原子的价层电子排布图:_________________________________________;F基态原子的价电子排布式:________________________________________。
(2)下列说法错误的是________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为_____________________________________(用元素符号表示)。
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为________。
(6)D与F形成离子个数比为1∶1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率________。
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
⑴请写出:D基态原子的价层电子排图: ______ ;F 基态原子的外围电子排布式: ______ .
⑵下列说法错误的是 ______ .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为 ______  用元素符号表示
用元素符号表示 .
.
⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有 ______ .
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 ______ .
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 ______ .
-
现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
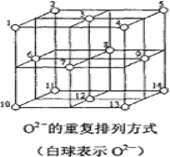
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
-
现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
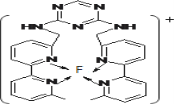
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
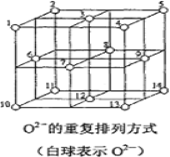
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序 。
(2)下列说法错误的是 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物 (高或低),原因是 。
(4)B单质的一种同素异形体的晶胞如图甲所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为 cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
① F原子的外围电子排布式为________。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为 。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图乙所示的离子:该离子中碳原子的杂化方式有 。
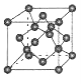
图甲 图乙
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序 。
(2)下列说法错误的是 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物 (高或低),
原因是 。
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为 cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为________ __。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为 (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有 。