-
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ SO2+2H2O+I2 = H2SO4+2HI Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4 = 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。

a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
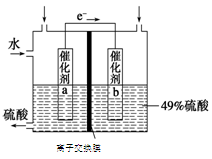
①a电极的电极反应式为 ;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为 。
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为 。
-
目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:



由甲烷制氢气的一个缺点是________。
(3)将 进行热分解也可以制得氢气
进行热分解也可以制得氢气
 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金( )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的 、
、 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为 得到的混合物
得到的混合物 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金( )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的 的
的 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出 。
。
 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出 的物质的量为________。
的物质的量为________。
-
科学家预测“氢能”将是未来21世纪最理想的新能源.利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为:2H2O
 2H2+O2,其循环过程分三步进行:
2H2+O2,其循环过程分三步进行:
(a) SO2+I2+H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O,下列分析不合理的是( )
A.由于硫酸很稳定,所以反应(c)最难进行
B.该循环过程不需要很高的热能,即就是在较低温度下才能进行
C.生成的SO2和I2可以循环使用,其它产物对环境无污染
D.该过程耗能太大,把太阳能用到上述循环中,该工艺将是合理的
-
科学家预测“氢能”将是未来最理想的新能源.请回答下列问题:
(1)实验测得,1克氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为______
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2↑
HgBr2+H2↑
③HgBr2+CaO HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑
上述过程的总反应可表示为______.
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题.下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘.
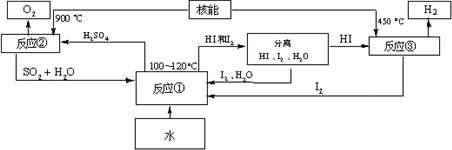
请写出反应①的化学方程式:______.
用硫-碘热循环法制取氢最大的优点是______.
(4)也有人认为利用氢气作为能源不太现实.你的观点呢?请说明能够支持你的观点的两点理由______.
-
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。
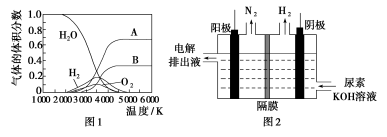
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
-
随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
Ⅰ.(1)生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式: 。
(2)热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
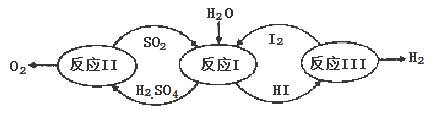
请回答下列问题;
①该循环工艺过程的总反应方程式为 .
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是 。
(3)最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是 (填“催化剂”或“中间产物”),若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为 。
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是 .
Ⅱ.(4)氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX ,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix 的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixH6+6NiO(OH)  LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为: 。
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为: 。

-
“氢能”是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出 热量,则氢气燃烧的热化学方程式为________
热量,则氢气燃烧的热化学方程式为________ 填序号
填序号 。
。
A.

B.

C.

D.

(2)某化学家根据“原子经济”的思想,设计了如下制备 的反应步骤:
的反应步骤:




请你根据“原子经济”的思想完成上述步骤 的化学方程式:__________。并根据“绿色化学”的思想评估该方法制
的化学方程式:__________。并根据“绿色化学”的思想评估该方法制 的主要缺点:_______。
的主要缺点:_______。
(3)利用核能分解水制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。
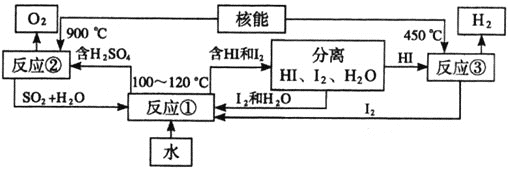
完成下列反应的化学方程式:
反应 :________________________________;
:________________________________;
反应 :________________________________。
:________________________________。
此法制取氢气的最大优点是________________________________。
-
在新能源中,氢能将会成为21世纪最理想的能源,但现阶段氢气的主要用于合成氨工业。
Ⅰ.已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(1)H2燃烧的热化学方程式是__________________。
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是_____________。
Ⅱ.德国人发明了合成氨反应,其原理为: N2(g)+3H2(g) 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1, 在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示。
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1, 在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示。
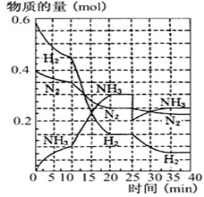
(1)10分钟内用氨气表示该反应的平均速率,V(NH3)= ________
(2)在10-20分钟内氨气浓度变化的原因可能是 (填空题)
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)N2(g)+3H2(g)  2NH3(g);该可逆反应达到平衡的标志 (填字母)
2NH3(g);该可逆反应达到平衡的标志 (填字母)
A.3v正(H2)=2v逆(NH3)
B.混合气体的密度不再随时间变化
C.容器内的压强不再随时间而变化
D.N2、H2、NH3的分子数比为1:3:2
E.单位时间生成nmolN2,同时生成3nmolH2
F.amol 氮氮三键断裂的同时,有6 amol氮氢键合成
-
氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
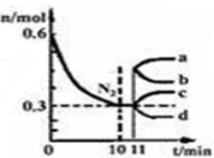
(1)氢气也可以作为化工生产的原料,如一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
(2)在工业上也可以利用氢气合成液体燃料。如:工业上合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
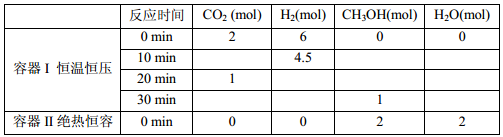
达到平衡时,反应I、II对比:平衡常数K(I)_______K(II)(填“>”“<”或“=”)。保持其他条件不变的情况下,若30 min时只向容器I中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。
(3) 100 kPa时,绝热密闭容器中发生反应2NO(g)+O2 (g) 2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
: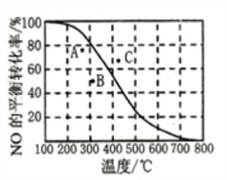
300℃时,VmL NO和0.5mLO2混合发生该反应,最终混合气体的平均摩尔质量为: _________(用含V的计算式表示)。图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则_____点对应的压强最大。若氧气中混有氮气,容器中还同时发生了如下反应N2(g)+O2(g)  2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
-
(14分)“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K (填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a (填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
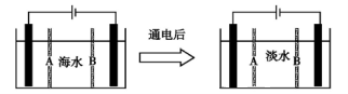
(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
H2+I2
H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。

2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。










