-
(16分)化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的离子方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
-
化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
(2)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=________________。
(3)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为______,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度_______(选填“增大”、“减小”或“不变”)。
(4)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅰⅰ.

①写出此条件下,反应A的热化学方程式___________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为__________kJ。
-
化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
(2)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=________________。
(3)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为______,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度_______(选填“增大”、“减小”或“不变”)。
(4)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅰⅰ.

①写出此条件下,反应A的热化学方程式___________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为__________kJ。
-
化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
-
化学反应原理对化学反应的研究具有指导意义
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
 :
:
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
-
Ⅰ.机动车废气排放已成为城市大气污染的重要来源。
(1)气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
(2)汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
Ⅱ.在体积恒定的密闭容器中投入物质A和物质B在适宜的条件下发生反应:
A(s)+2B(g) 2C(g)+D(g)
2C(g)+D(g)
(1)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图所示。

则T1 T2(填“>”、“<”或“=”),该反应的正反应的△H 0(填“>”、“<”或“=”)。
(2)若该反应的逆反应速率与时间的关系如下图所示:
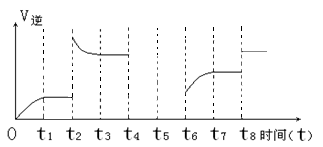
①由图可见,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,则t8时改变的条件是 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
-
Ⅰ.机动车废气排放已成为城市大气污染的重要来源。
(1)气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
(2)汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
Ⅱ.在体积恒定的密闭容器中投入物质A和物质B在适宜的条件下发生反应:
A(s)+2B(g) 2C(g)+D(g)
2C(g)+D(g)
(1)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图所示。

则T1 T2(填“>”、“<”或“=”),该反应的正反应的△H 0(填“>”、“<”或“=”)。
(2)若该反应的逆反应速率与时间的关系如下图所示:
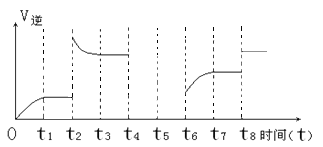
①由图可见,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,则t8时改变的条件是 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
-
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程式____
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是___________。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈_____________。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据:______________。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为______。
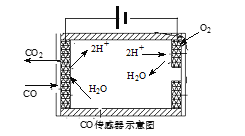
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 =__________kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式____________。
-
(14分)汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程
。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据: 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
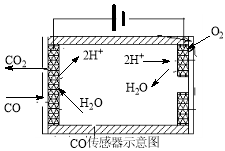
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 。
-
汽车废气排放已成为城市大气污染的重要来源,汽车排气系统中安装三元催化器可同时将废气中的三种主要有害物质转化为无害物质。
反应Ⅰ:4CO(g)+2NO2(g)  N2(g)+4CO2(g) ΔH=-1196 kJ/mol
N2(g)+4CO2(g) ΔH=-1196 kJ/mol
反应Ⅱ:2CO(g)+2NO(g)  N2(g)+2CO2(g)
N2(g)+2CO2(g)
(1)已知: ①N2(g) + O2(g)=2NO(g) ΔH=+180.5kJ/mol
② 2CO(g) + O2(g)=2CO2(g) ΔH=-566.0kJ/mol
则反应Ⅱ的 ΔH=_________,ΔS______0(填“>”、“<”或“=”)
(2)进一步探究上述反应Ⅱ中 NO 的平衡转化率与压强、温度的关系,得到图 1 所示的曲线。根据图像,控制反应 II进行的合适条件:温度为_________________,压强为常压(1.01MPa) ,选择该压强的原因是________________________。
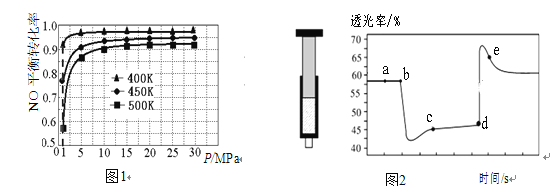
(3)模拟反应Ⅰ:将一定量的 CO 与 NO2 充入装有催化剂的注射器中进行反应。图2是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小) 根据图像,回答下列问题:
①a、 c、 e 三点 c(NO2)由小到大的顺序是____________________;
②e 点速率:υ(正)_________υ(逆)(填“>”、“<”或“=”,下同);
③若注射器绝热,平衡常数 K(b)_________ K(d)。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
2Cl2+2H2O

 :
:








