-
用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
 MnO2 +
MnO2 + Fe2++
Fe2++ =
= Mn2+ +
Mn2+ +  Fe3+ +
Fe3+ +
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 。
-
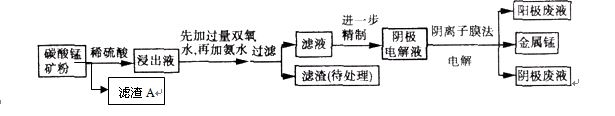
某种碳酸锰矿的主要成分有MnCO3 、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式________。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因.
(3)(5分)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:

加氨水调节溶液的pH等于6,则滤渣的成分是________,滤液中含有的阳离子有H+和 ________。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是________极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为________。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式________ 。
-
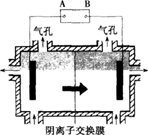
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
阴离子膜法电解装置如下图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式:。
(2)已知Ksp (Fe(OH)3) = 4 ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3 沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg = -0.1 lg
= -0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是________ (写化学式),滤液中含有的阳离子有H+和________(写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因:________。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的________极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为________。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式:________。
-
工业上以某软锰矿(主要成分为MnO2,还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
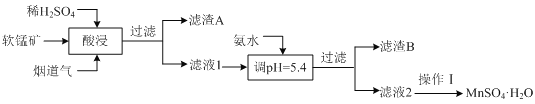
(1)滤渣A的主要成分是_________(填化学式)。
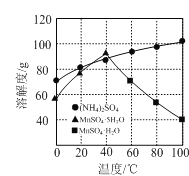
(2)操作Ⅰ为加热(煮沸)结晶、趁热过滤、洗涤、干燥。根据下图溶解度曲线分析,趁热过滤的目的除了防止MnSO4·H2O中含有(NH4)2SO4外,还有____________________。
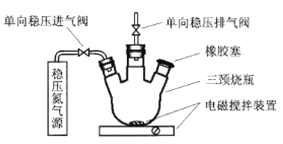
(3)MnSO4常用于测量地表水的DO值(每升水中溶解氧气的质量,即溶氧量)。我国《地表水环境质量标准》规定,生活饮用水源的DO值不得低于5 mg·L-1。李明同学设计了如下实验步骤测定某河水的DO值:
第一步:使如图所示装置中充满N2后,用注射器向三颈烧瓶中加入200 mL水样。
第二步:用注射器向三颈烧瓶中依次加入一定量MnSO4溶液(过量)、碱性KI溶液(过量),开启搅拌器,发生下列反应:Mn2++O2+OH-→MnO(OH)2↓(未配平)
第三步:搅拌并向烧瓶中加入一定量H2SO4溶液,在酸性条件下,上述MnO(OH)2将I-氧化为I2,其反应如下: MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)
第四步:从烧瓶中取出40.00 mL溶液,与0.010 mol·L-1Na2S2O3溶液发生反应:2S2O32—+I2=S4O62—+2I-,恰好完全进行时,消耗Na2S2O3溶液4.40 mL。
①在配制第二、三步所加试剂时,所有溶剂水须先煮沸后再冷却才能使用,将溶剂水煮沸的作用是_____。
②通过计算判断作为饮用水源,此河水的DO值是否达标______ (写出计算过程,不考虑第二、三步加入试剂后水样体积的变化)。
-
某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
-
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:生成氢氧化物沉淀的pH

注:金属离子的起始浓度为0.1 mol/L,回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 _______ ___________ 。盐酸溶解MnCO3的化学方程式是_______ ______________ ___ _____。
(2)向溶液1中加入双氧水时,反应的离子方程式是 _______ ___________ 。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是 ________ 。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□________=□________+□________+□________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 阳极生成MnO2的电极反应式是 ____ ___ ____________ _______ 。
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 _____ 。
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 ___ __ 。
-
工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:
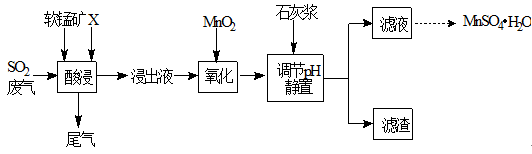
已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。

(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
-
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
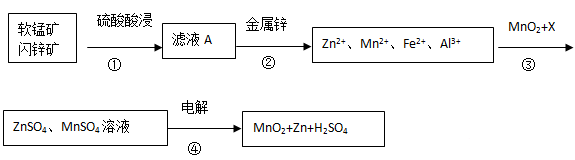
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______。
(2)步骤③中MnO2的其作用是______,另外一种物质X可以是______。
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式______。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______.
(4)已知:H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
-
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
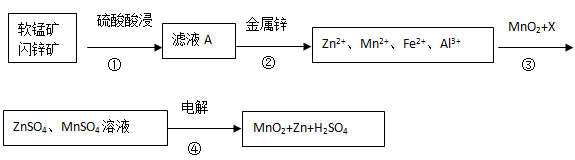
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______。
(2)步骤③中MnO2的其作用是______,另外一种物质X可以是______。
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式______。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______.
(4)已知:H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
-
【化学选修2 -化学与技未】
I.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2 、A12O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。 滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:

①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__ ___。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。

II.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质。由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
| 离子 | Fe3+ | Fe2 + | Cu2+ |
| 开始沉淀pH | 1.9 | 7.0 | 6.7 |
| 沉淀完全pH | 3.4 | 9.0 | 10.0 |
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是 。
(2)溶液1的成分是 ,若向其中通入足量的CO2可以析出的沉淀是 ,此时溶液中的溶质将变成 。
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为: 。
(4)溶液2调节的pH范围为 。
(5)对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3。检验红褐色沉淀是否洗净的方法是 。
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为: ;当两极共产生标准状况下44.8 L气体且阴阳两极产生的气体体积之比为1: 1时,则析出的铜的质量为 。
MnO2 +
Fe2++
=
Mn2+ +
Fe3+ +


















