-
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
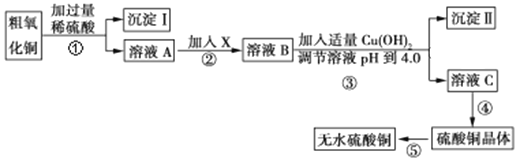
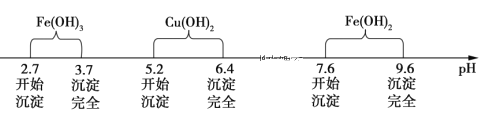
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为____________mol·L−1。
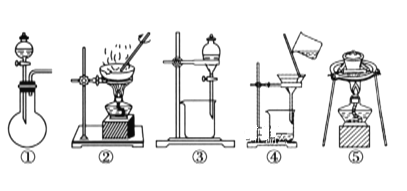
(2)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
(3)溶液A中所含溶质为__________________________;物质X应选用________(填序号)。
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI反应的离子方程式为______________________________。
②滴定终点的现象是____________________________________________________________。
③溶液A中c(Cu2+)=________mol·L-1。
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是___________(填序号),写出其在a处所发生的化学反应方程式___________________________________________。
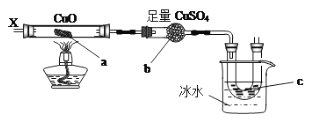
A.H2
B.CH3CH2OH(气)
C.N2
-
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
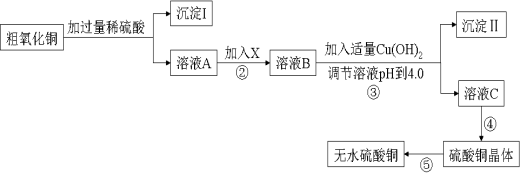
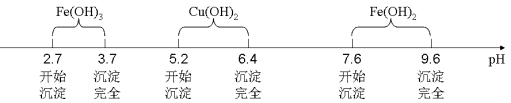
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填序号)
① ② ③ ④ ⑤
(2)溶液A中所含溶质为 ;
(3)物质X应选用 (填序号),沉淀II的主要成分是
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为 。
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为 。
②滴定中,试液Na2S2O3应放在  (填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
(填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
③溶液A中c(Cu2+)= mol·L-1
-
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
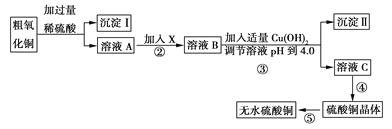
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
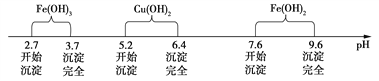
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
(2)溶液A中所含溶质为________;物质X应选用________(填序号)。
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(4)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O ===2I-+S4O
===2I-+S4O )
)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为______________________________。
②滴定中,Na2S2O3标准溶液应放在________(填“酸式滴定管”或“碱式滴定管”)中,滴定终点的现象是______________________________。
③溶液A中c(Cu2+)=________mol·L-1。
-
某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取氯化铜,其实验流程如下所示:
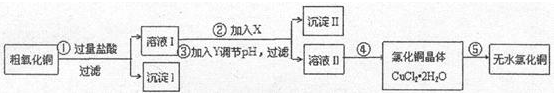
已知:
| 金属离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
提供的试剂:A.NaOH B.H2O2 C.Na2CO3 D.CuO
(1)步骤②反应的离子方程式是 。步骤③中调节溶液pH的范围是 。
(2)如何判断沉淀Ⅱ已洗涤干净的方法是 。
(3)步骤④的方法是 ,
(4)步骤⑤要得到无水氯化铜,需要在赶在的HCl气流中加热CuCl2•2H2O2其原因是 。
(5)若用电解法精炼铜,则阴极的电极反应式为
-
(14分)过氧化钙难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:
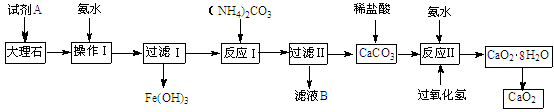
请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用 。
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是 。
(3)滤液B主要成分的化学式是 。
(4)反应Ⅱ是放热反应。保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降。试分析CaO2产率下降的可能原因是 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入10 mL蒸馏水和20 mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数。
| 实验 | 1 | 2 | 3 | 4 |
| V(KMnO4) /mL | 19.50 | 21.50 | 19.48 | 19.52 |
已知:上述实验过程中反应关系为:CaO2~H2O2 ,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是 ;
(6)由表中数据可知,该样品中CaO2含量为 %。若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果 (填“偏高”、“偏低”或“无影响”)。
-
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下:
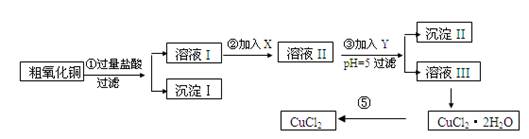
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
表Ⅱ
| 氧化剂 | 调节pH的物质 |
| A | 双氧水 | D | 氨水 |
| B | 高锰酸钾 | E | 碱式碳酸铜 |
| C | 氯水 | F | 氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是________。
(2)步骤②加入的试剂X可选用表Ⅱ中的________(填序号),其作用是________。
(3)步骤③加入的试剂Y可选用表Ⅱ中的________(填序号),控制pH=5的目的是。
(4)步骤⑤要得到无水CuCl2,应控制的条件是。
(5)步骤①中所发生的全部反应的离子方程式:
。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
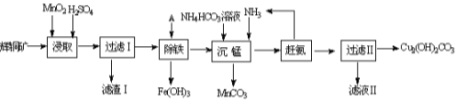
①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过__________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式__________________________ 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是____________________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了________mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总 质量相差__________g
质量相差__________g
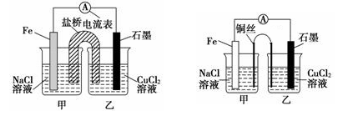
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
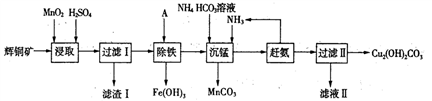
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
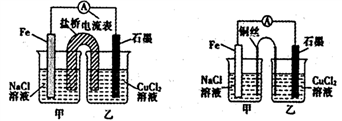
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
-
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
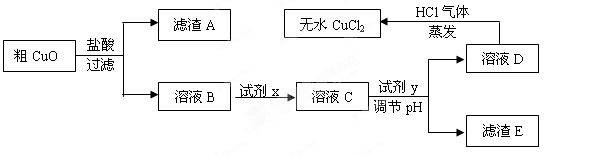 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=________。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是________
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是________(填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为________。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是________(填以下选项序号),原因是________。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是________。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于 mol
mol
C.粗CuO中所含的铜元素的质量分数为 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定
-
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
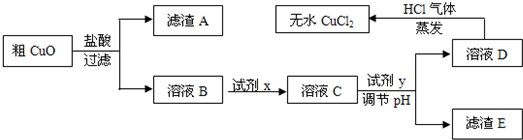
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=______.
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是______.
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是______(填以下选项序号).
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为______.
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是______(填以下选项序号),原因是______.
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是______.(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于 B.粗CuO中CuO物质的量小于
B.粗CuO中CuO物质的量小于  mol
mol
C.粗CuO中所含的铜元素的质量分数为 x100%
x100%
D.粗CuO中关于CuO的量无法确定.



===2I-+S4O
)














 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答: