-
Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所
示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下
列问题:
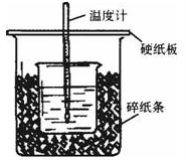
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________________
(2)在测定中和热的实验中,计算反应热时需要的数据有________________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_______ (填“相等”或“不相等”),所放出的热量____ (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_____(填“偏大”、“偏小”或“无影响”).
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g) CH3OH(g)。已知:①下图为反应的能量变化和物质键能
CH3OH(g)。已知:①下图为反应的能量变化和物质键能

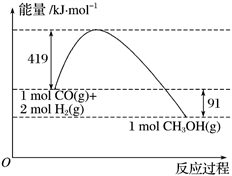
②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
-
某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
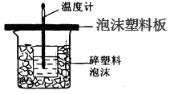
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________;由图可知该装置有不妥之处,应如何改正? 。
(2)实验中改用60 mL0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会______________(填“相等”或 “不相等”),理由是_____________________________。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
(4)将V1ml 1.0mol/L HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)
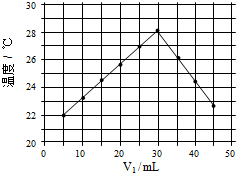
通过分析图像可知,做该实验时环境温度 (填“高于”,“低于”或“等于”)22℃,该NaOH溶液的浓度约为 mol/L。
-
50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
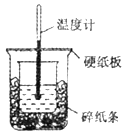
A.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C.用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大
D.实验中改用60mL0.5mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等
-
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
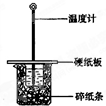
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60mL0.50mol/L盐酸跟50mL0.5mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
-
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
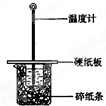
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60mL0.50mol/L盐酸跟50mL0.5mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
-
(10分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;装置的不足之处是________ ;不加以改正,所求的值将 ________(填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
-
(10分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;装置的不足之处是________ ;不加以改正,所求的值将 ________(填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
-
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;本装置的不足之处是________ ;不加以改正,所求的值将
________(填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
-
用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)仔细观察实验装置,图中是否缺少一种玻璃仪器,如果缺少,缺少的是______________(填仪器名称,如果不缺少,此空不填),图中是否有不妥之处,如果有请指出:________________________(如果没有,此空不填)。
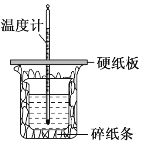
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将______(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”或“不相等”),简述理由:____________________________。
-
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
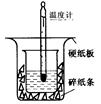
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是________。装置中还存在的2个错误是①__
②________这种错误会造成最高温度读数________(填“增大”、“减小”或“无影响”);测得的中和热将____________(填“偏大”、“偏小”或“无影响”)。
(2)在实验过程中,该同学需要测定并记录的实验数据有 ________(填序号)。
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.反应后混合溶液的终止温度
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________;(填“偏大”“偏小”或“无影响”)。

CH3OH(g)。已知:①下图为反应的能量变化和物质键能










