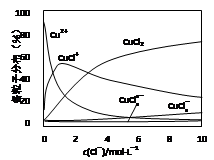-
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=________kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作________极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是________(写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为________。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。
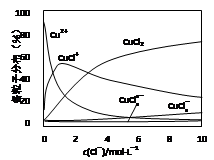
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为________。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为________(任写一个)。
-
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,
2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH= ________kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作________极。
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是____________(写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为________。
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。
①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为__________________________。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为___________________________,___________________________(任写两个)。
-
(10分)铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H = -768.2kJ·mol-1,
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H = +116.0kJ·mol-1,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: 。
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。
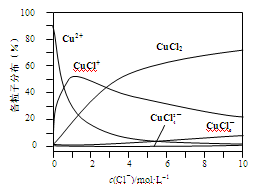
①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
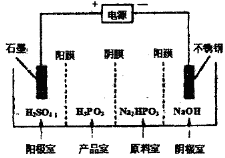
(3) 电解Na2HPO3溶液可得到亚磷酸,装置如下图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
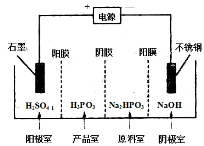
①阳极的电极反应式为: ____________。
②产品室中反应的离子方程式为: _____。
-
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
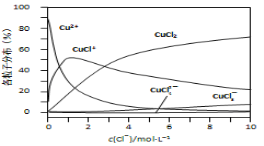
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
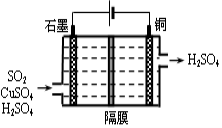
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
-
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1, ①
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1, ②
①热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。
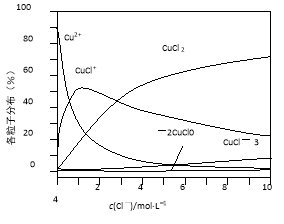
①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
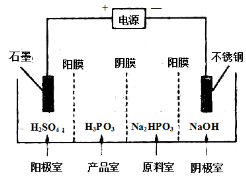
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
-
(14分)铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
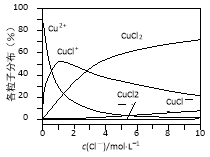
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
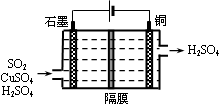
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
-
铜及其化合物在工农业生产及日常生活中应用非常广泛。
⑴由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol- 1,
1,
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1,
①写出Cu2S与O2生成 Cu(s) 和SO2的热化学方程式: 。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
⑵氢化亚铜是一种红色固体,可由CuSO4溶液和H3PO2反应制备。该反应的化学方程式为 。该反应每转移3mol电子,生成CuH的物质的量为 。
⑶氯化铜溶液中含铜粒子的分布分数与c(Cl-) 的关系如图所示。①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜微粒浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜微粒间转化的离子方程式为 (任写一个)。
-
铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料。
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) △H=+116.0kJ/mol
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=__________。
(2)利用化石燃料开采、加工过程产生的H2S废气可制取氢气,既廉价又环保,若得到56L(标准状况)氢气,则转移的电子属为________。
(3)上述冶炼过程中会产生大量的SO2,回收处理SO2不仅能防止环境污染,而且能变害为宝。回收处理的方法之一是先将SO2转化为SO3,然后再转化为H2SO4。
①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g) 2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
A.容器内气体密度不变 B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.容器内压强不再发生交化
②450℃、0.1Mpa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(a)随着时间(t)的变化如图1所示。则该温度下反应的平衡常数K=_____。若维持其他条件不变,使反应开始时温度升高到500℃ ,请在图l中画出反应从开始到平衡时SO2转化率的变化图像_______。
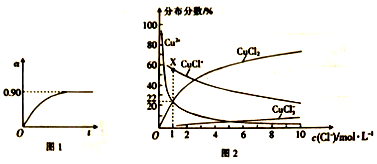
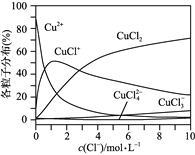
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl-)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中各含铜微粒物质的量占铜元素总物质的量的百分比)。
①若溶液中含铜微粒的总浓度为amol/L,则X点对应的c(CuCl+)=___________ (用含a的代数式表示)。
②向c(Cl-)=1mol/L的氯化铜溶液中滴人少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为__________。
-
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=________.
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)⇌2SO3(g).
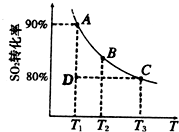
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H________O(填“>”或“<”).反应进行到状态D时,v正________v逆(填“>”、“<”或“=”).
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol•L-1,则0~10min内的平均反应速率v(SO2)=________,该温度下反应的平衡常数K=________.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是________
A.向容器中通入少量O2 B.向容器中通入少量SO2C.使用催化剂 D.升高温度E.恒容通入少量氦气
⑤气体SO2是大气污染物,可选用下列试剂中的________吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
-
铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
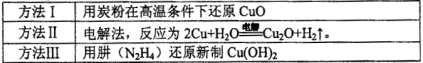
①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是____________。
②已知:
2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJ•mol-1,
C(s)+1/2O2(g)═CO(g)△H=-110.5kJ•mol-1,
Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu20(s)+CO(g); △H=____________kJ/mol。
(2)氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4.
该反应每转移3mol电子,生成CuH的物质的量为____________。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。
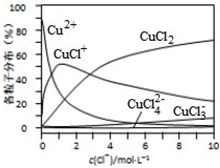
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为____________。
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为____________(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为____________,(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3•L-3)
②电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为____________。