-
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
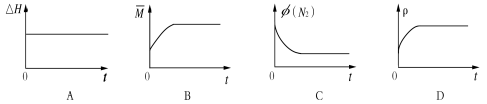
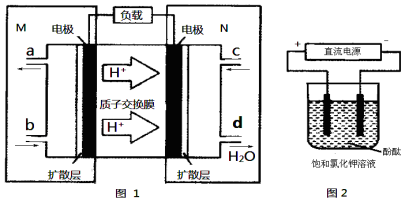
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
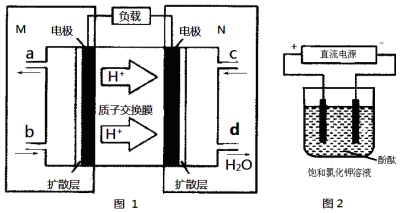
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)  H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)  H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)  H= 。(请用含有
H= 。(请用含有 H1、
H1、 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。

(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
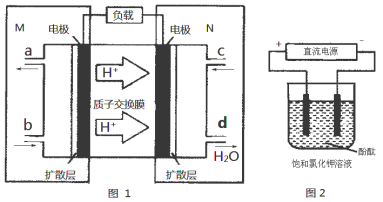
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为 g(假设溶液电解前后体积不变)。
-
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
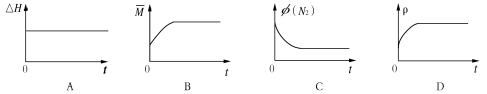
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
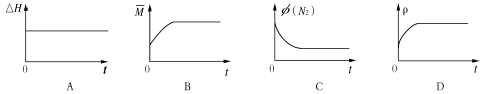
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
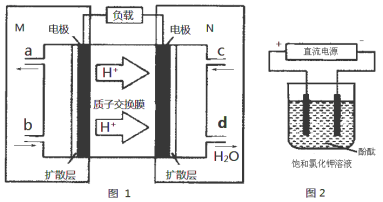
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定) ,若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
,若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH= 。(请用含有ΔH1、ΔH2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度/K | 平衡时NH3的物质的量/mol |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
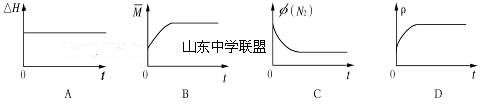
③下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
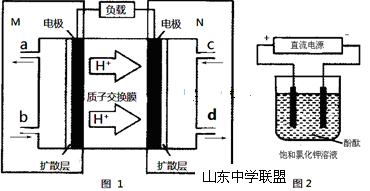
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
液氨作为一种潜在的清洁汽车燃料已越来越被重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。
(1)氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的ΔH=_____。(请用含有ΔH1、ΔH2的式子表示)
(2)氨气可以直接用于燃料电池,选择碱性溶液作为电解质溶液,写出负极的电极反应式__________。
(3)已知合成氨反应的方程式为N2+3H2 2NH3,其平衡常数K的数值和温度的关系如下:
2NH3,其平衡常数K的数值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.00 | 0.86 | 0.50 |
①由上表数据可知该反应ΔH______0(填“>”或“<”)。
②400℃时,测得某时刻c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,此时刻该反应的v正____v逆(填“>”“=”或“<”)。
(4)下图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后合成NH3,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
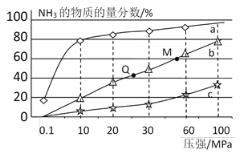
①曲线a对应的温度是__________________。
②关于合成氨的反应,下列叙述正确的是________。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 图中M、Q点平衡常数K的关系是K(M)>K(Q)
③M点对应的H2的转化率是____________________。
④400℃时,将1mol N2和3mol H2充入恒压密闭容器中,下图分别代表焓变(ΔH)、混合气体平均相对分子质量(M)、N2质量分数[φ(N2)]和混合气体密度(ρ)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是_____________________。

-
液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。请回答下列问题:
Ⅰ.已知反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
| 化学键 | H-H | N≡N | N-H |
| 键能/kJ·mol-1 | 436 | 946 | 391 |
(1)反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
(2)已知:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
则△H1、△H2、△H3三者之间的关系为:△H3= ______________ ;
Ⅱ.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,工作原理如图所示。
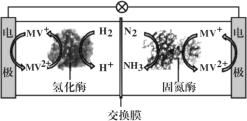
(3)负极的电极反应式为_______________;
(4)当电路中通过3mol电子时,可产生氨气的体积(标况下)为_______L;正极区中n(H+)______(填“增加”、“减少”或“不变”);
(5)该装置在高温下不能正常工作,原因是_____。
-
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

-
氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因是:____________________________________________。
(2)在恒温条件下,1 mol NO2和足量C发生反应2NO2(g)+2C(s) N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
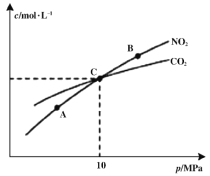
①A、B两点的浓度平衡常数关系:Kc(A) ___________Kc(B)(填“<”或“>”或“=”)
②A、B、C三点中NO2的转化率最高的是___________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp=___________MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)已知:亚硝酸(HNO2)性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常温下向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小的顺序是______________________。
(4)已知:常温下甲胺(CH3NH2)的电离常数为Kb,且pKb=-lgKb=3.4水溶液中有CH3NH2+H2O⇌CH3NH3++OH-。常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,则溶液pH=_______。
(5)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) ⇌CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) ⇌CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反应CaO(s)+3CO(g)+SO2(g) ⇌CaS(s)+3CO2(g) △H=___________ kJ· mol-1
-
氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s) N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
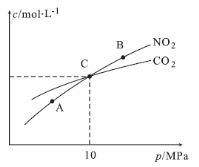
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO₃的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
②CaSO4(s)+ 4CO(g) CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
反应CaO(s)+3CO(g)+SO2(g)  CaS(s)+3CO2(g) △H= kJ•mol-1;
CaS(s)+3CO2(g) △H= kJ•mol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。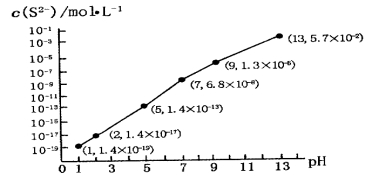
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
















