-
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g) FeO(s)+H 2 (g) 平衡常数为 K2;
FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下, K1、K2值如下:

(1)在500℃时进行反应①,若CO2起始浓度为1mol·L -1,10分钟后达到平衡,则V(CO)为______。
(2)在 900℃时反应 CO2 (g)+H2(g) CO(g)+H2O(g)的平衡常数 K=___________。
CO(g)+H2O(g)的平衡常数 K=___________。
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有______(选填编号)。
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃ D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是________(选填编号)。
A.v正(CO)= v 逆 (CO2) B.C(CO) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度______________;
②再通入CO2,CO2的转化率_________________。
(6)下列图像符合反应①的是__________(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)
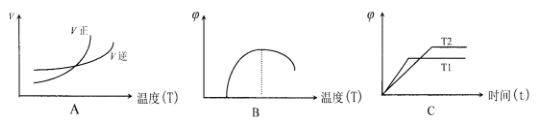
-
已知:反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)⇌FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 700 | 1.47 | 2.38 |
| 900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)⇌CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.
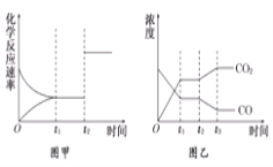
-
(14分)
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2
FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g) CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应
CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应
CO2(g) + H2(g) CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
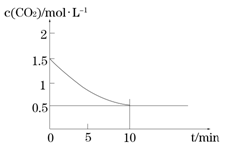
① 该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________mol·L-1。
②下列措施中能使平衡时 增大的是 (填序号)
增大的是 (填序号)
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
-
(10分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2
FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g) CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
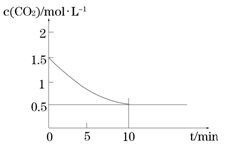
① 该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度________mol·L-1。
②下列措施中能使平衡时 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
-
(10分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2
FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g) CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:

① 该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度________mol·L-1。
②下列措施中能使平衡时 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
-
反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)计算温度为973K时,反应CO2(g)+H2(g) CO(g)+H2O(g) K=__________;
CO(g)+H2O(g) K=__________;
(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
①该反应能够自发进行的原因是___________________________。
②下列措施中能使c(CH3OH)增大的是________。
a.降低温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2________T1(填“>”、“<”或“=”)。
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
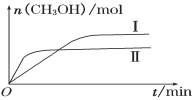
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物 投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为________________ 。
-
)设反应①Fe(s)+CO2(g) FeO(s)+CO(g) △H = Q1的平衡常数为K1,
FeO(s)+CO(g) △H = Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g) △H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) △H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
| 温度( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是_______(填“放”或“吸”)热反应;K2的数学表达式为________。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g) △H = Q3 ①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
CO(g)+H2O(g) △H = Q3 ①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3 =_____________。
-
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个________(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有________(填序号)。
CO(g)+H2O(g),这是一个________(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有________(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率________ (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率________ (填序号)。
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。

①图示可知,分析HNO3与铁反应的规律是________。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是________。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是________ (填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
-
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
| 700 ℃ | 900 ℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
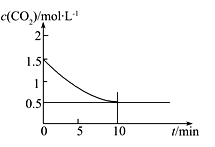
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a. 容器中的压强不变 b.气体的密度不再改变
c. v正(CO2)=v逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
-
设反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)⇌FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是______(填“放”或“吸”)热反应.
(2)现有反应③H2(g)+CO2(g)⇌CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=______;可推断反应③是______(填“放”或“吸”)热反应;要使反应③在一定条件下建立的平衡右移,可采取的措施有______.
A.缩小容器体积 B.降低温度 C.使用合适的催化剂D.设法减少CO的量 E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=______.
FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+H2(g) △H2,平衡常数为K2
CO(g) + H2O(g) △H ,平衡常数K,则△H=________(用△H1和△H2表示),K=________(用K1和K2表示),且由上述计算可知,反应
CO(g) + H2O(g)是________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)达到化学平衡状态的依据是________(填序号)。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:

增大的是 (填序号)







