-
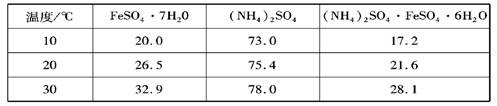
(6分)硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:10% Na2CO3溶液、Fe屑、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为________________,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用________________洗涤晶体。
(4)称量生成的硫酸亚铁铵的质量,理论上为________________g。
-
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4•FeSO4•6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/l00gH2O)见下表:
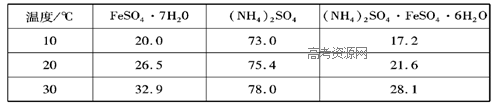
| 温度℃ | FeSO4•7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
实验用品:10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为______,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用______洗涤晶体.
(4)称量生成的硫酸亚铁铵的质量,理论上为______g.
-
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图:
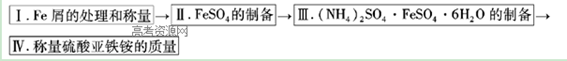
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是________,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)
-
亚铁盐在空气中易被氧化,但是形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O 商品名莫尔盐]是一种重要的化学试剂,实验室用废铁片制取硫酸亚铁铵的流程如下方案一所示:
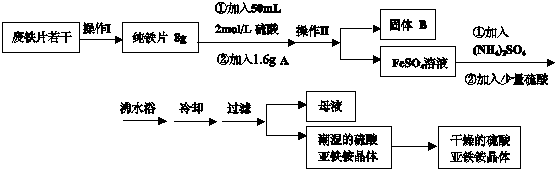
请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂______(填序号)
a.H2O b.3mol•L-1 H2SO4 c.热的10%的Na2CO3溶液
(2)若A物质为CuSO4,其加入的目的是______,则固体B的成分为______.
(3)操作Ⅱ的名称是______,所用主要玻璃仪器有:烧杯、______.
(4)加入少量硫酸可以调节pH为1~2,其作用是______(结合化学用语和简要语言说明).
(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:______.
(6)在此流程中,理论上得到硫酸亚铁铵晶体______g(精确到小数点后两位).
相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的CuSO4可以发生多种化学反应,如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是______ 2CuCl↓+SO42-+2H+
-
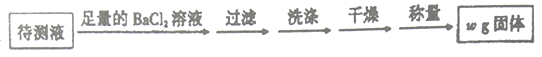
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。
Ⅰ.化学课外活动小组研究莫尔盐晶体强热时的分解产物。
(1)甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是___________,由此可知分解产物中有_____________。
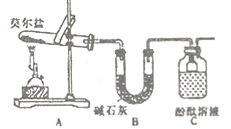
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
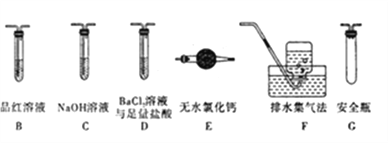
①乙组同学的实验中,装置依次连接的合理顺序为A、__________________。
②装置D中足量盐酸的作用是____________;含有SO3的实验现象是_______________。
Ⅱ.为测硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500mL溶液.甲、乙、丙三位同学设计了如下三个实验方案,请回答:
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol·L-1的酸性KMnO4溶液分三次进行滴定。
乙方案:取25.00mL硫酸亚铁铵溶液进行如下实验。
丙方案:(通过NH4+测定)实验设计图如下图所示,取25.00mL硫酸亚铁铵溶液进行该实验。
(3)甲方案中的离子方程式为______________________,若实验操作都正确,但其测定结果总是小于乙方案,可能原因为________________,验证推测的方法为___________________________________ 。
(4)乙方案中沉淀是否洗涤干净的检验方法是______________________________。
(5)丙方案中量气管中最佳试剂是__________________
a.水 b.饱和NaHCO3溶液 c.CCl4
(6)若测得NH3体积(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为_________________。
-
硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4•7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4•FeSO4 | 17.2 | 21.6 | 28.1 |
(一)实验室制取少量莫尔盐的流程如图:
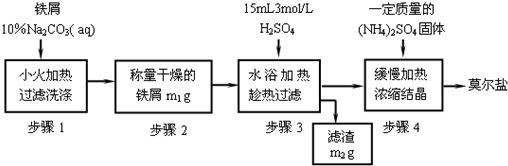
试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是______;反应中铁屑过量是为了______.
(2)步骤3需要趁热过滤,原因是______.
(3)从步骤4到莫尔盐,必须进行的操作依次是______,析出的晶体常用______洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是______(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式______.
(2)判断该反应到达滴定终点的现象为______.
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为______mol/L.
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
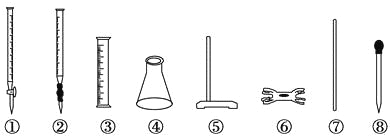
A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。

A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
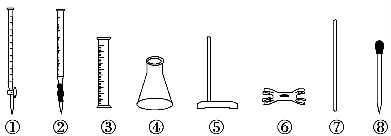
A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
(16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:
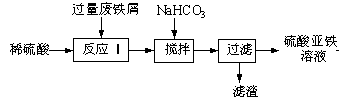
回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL• L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol•L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol•L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式: MnO4-+ Fe2++ H+—— Mn2++ Fe3++ H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol•L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL• L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g• mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。














