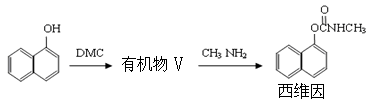-
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=_____。
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。


(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(下图),判断下列说法正确的是_____________。

a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
-
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2+2CH3OH―→CO(OCH3)2+H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。
计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。

(2)根据反应温度对TON的影响图(图1)判断该反应的焓变ΔH____0(填“>”、“=”或“<”),理由是_________。
(3)根据反应时间对TON的影响图(图2),已知溶液总体积 10 mL,反应起始时甲醇0.25 mol,催化剂0.6×10-5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量TON的影响图(图3),判断下列说法正确的是________。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
-
碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH→CO(OCH3)2 + H2O 。某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是
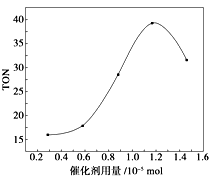
A.由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
B.在反应体系中添加合适的吸水剂,将提高该反应的TON
C.当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点
D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低
-
油漆、胶粘剂行业的新型溶剂——碳酸二甲酯(简称DMC)是近年来受到国内外广泛关注的环保型绿色化工产品。其分子结构中含有特别的原子基团 ,无机物H2CO3也可以写成
,无机物H2CO3也可以写成 结构。国内外现有DMC的合成方法很多,如酯交换法:
结构。国内外现有DMC的合成方法很多,如酯交换法:

(1)有机物I的结构简式为________;
(2)DMC参与以下反应①:
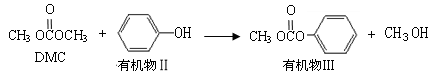
有机物III分子式为________;
有机物II与过量饱和溴水反应的化学反应方程式为________。
(3)DMC与足量NaOH溶液反应的化学方程式为________(注明条件)。
(4)有机物IV是有机物III的一种同分异构体,且IV具有以下性质特征:
A.是一种芳香族化合物 B.能与FeCl3发生显色反应
C.能发生水解反应,也能发生银镜反应 D.苯环上的一氯代物有两种
则有机物IV的结构简式为________。
(5)以DMC合成杀虫剂西维因的路线如下:
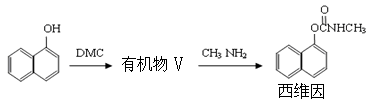
其中生成有机物V的反应类似于反应①,有机物V的结构简式为________。
1mol西维因最多可与________mol H2发生加成反应。
-
碳酸二甲酯(CO(OCH3))是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是
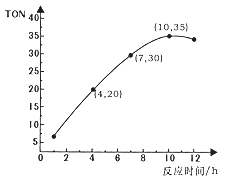
A. 在该温度下,最佳反应时间是10h
B. 4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1
C. 向反应体系中添加催化剂,一定能提高反应的TON
D. 该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义
-
碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。
已知:ⅰ CO的标准燃烧热:-283.0 kJ•mol-1,
ⅱ 1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量
ⅲ 2CH3OH(g)+CO2 (g)  CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
则2CH3OH(g)+CO (g)+ 1/2O2(g)  CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
(2)甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)  CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
① 写出该反应平衡常数表达式: 。
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是 (选填编号)。
A.v正(CH3OH)= 2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变
D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如下左图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。
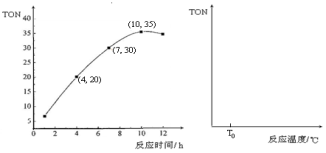
在该温度下,最佳反应时间是 ;4~10 h内DMC的平均反应速率是_ ___。
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在右上图坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)。
⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是 。
A.往反应体系中添加催化剂
B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2
D.扩大容器的体积
-
碳酸二甲酯(CH3OCOOCH3,简称DMC)在医药、农药、香料等多个领域具有广泛的应用,称为绿色化学品。目前,主要通过甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。主要副产物有HCOOCH3和CO2。请回答下列问题:
(1)已知:①CO的标准燃烧热为:−283.0 kJ•mol−1
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44.0 kJ的热量
③2CH3OH(g)+CO2(g)→CH3OCOOCH3(g)+H2O(g)△H=−15.5 kJ•mol−1
则2CH3OH(g)+CO(g)+1/2O2(g)→CH3OCOOCH3(g)+H2O(l)△H=______________ 。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(2)在制备DMC的实际工艺过程中,用活性炭负载法制得的催化剂比沉淀法制得的催化剂有更高的活性,说明影响催化剂活性的因素有______________ 。从化学反应原理分析,合适的催化剂在化学反应中的作用有①_________________, ②提高化学反应的选择性能。
(3)使用甲醇汽油可减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)→CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,该温度下,现往容器中继续通入3mol CO,此时v(正)__________ v(逆)(选填‘‘>”、“<’’或“=”),用数据说明理由__________________。
(4)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10−5 mol催化剂发生反应③,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如右图所示。(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。
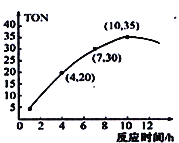
在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ 。
-
碳酸二甲酯(CH3OCOOCH3,简称DMC)在医药、农药、香料等多个领域具有广泛的应用,称为绿色化学品。目前,主要通过甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。主要副产物有HCOOCH3和CO2。请回答下列问题:
(1)已知:①CO的标准燃烧热为:−283.0 kJ•mol−1
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44.0 kJ的热量
③2CH3OH(g)+CO2(g)⇌CH3OCOOCH3(g)+H2O(g)△H=−15.5 kJ•mol−1
则2CH3OH(g)+CO(g)+1/2O2(g)⇌CH3OCOOCH3 (g)+H2O(l)△H=______________ 。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(2)在制备DMC的实际工艺过程中,用活性炭负载法制得的催化剂比沉淀法制得的催化剂有更高的活性,说明影响催化剂活性的因素有_______________ 。从化学反应原理分析,合适的催化剂在化学反应中的作用有①________________________, ②提高化学反应的选择性能。
(3)使用甲醇汽油可减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)⇌CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,该温度下,现往容器中继续通入3mol CO,此时v(正)__________ v(逆)(选填‘‘>”、“<’’或“=”),用数据说明理由__________________。
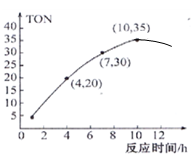
(4)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10−5 mol催化剂发生反应③,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ 。
-
碳酸二甲酯( 简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂。DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下:
简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂。DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下:

已知一定条件下,DMC也能发生酯交换反应:
(1)写出A物质的一种同分异构体的名称:_________;
(2)写出C的结构简式:_________;A与CO2的反应类型是_________;
(3)写出DMC与足量NaOH溶液反应的化学方程式:____________________;
(4)苯酚与DMC的反应因反应物用量不同,也可得到化合物F, 写出F的结构简式:_____;
(5)参照物质B的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线(注明必要的反应条件) ____________。
的合成路线(注明必要的反应条件) ____________。
合成路线常用的表示方式为:A B……
B…… 目标产物
目标产物
-
(共16分)近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H 1=-49.58 kJ•mol-1
CH3OH(g) +H2O(g) △H 1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+ H2(g) CO (g)+H2O(g) △H 2
CO (g)+H2O(g) △H 2
反应Ⅲ: CO(g)+2 H2(g) CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H 2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
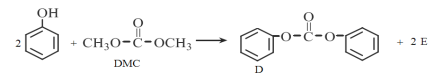
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。
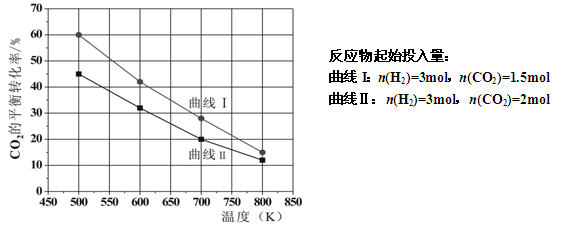
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是 ;
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
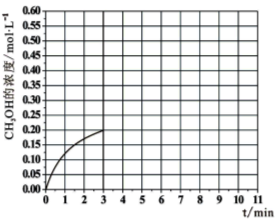
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= ;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、
Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示,请回答问题:
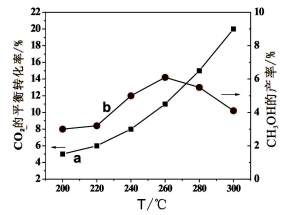
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 。