-
(物质结构与性质)黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:
2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K____________(填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为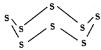 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为___________,,N2的沸点比CO的沸点__________(填“高”或“低”)。
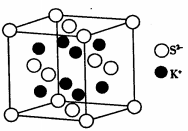
(5)K2S的晶胞结构如图所示。其中K+的配位数为_____________,S2-的配位数为__________;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为__________g·cm-3(列出计算式,不必计算出结果)。
-
黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K______ (填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为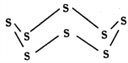 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为________,N2的沸点比CO的沸点____(填“高”或“低”)。
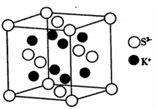
(5)K2S的晶胞结构如图所示。其中K+的配位数为_______,S2-的配位数为____;若晶胞中距离最近的两个S2-核间距为a cm,则K2S晶体的密度为____g·cm-3(列出计算式,不必计算出结果)。
-
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S + 2KNO3 + 3C → K2S + 3CO2↑+ N2↑。请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________;钾元素在周期表中的位置为___________________。

(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有_____种不同能级的电子;已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是__________________________________。
(3)上述反应生成物中,属于非电解质的是_________________(写结构式);其中熔点最高的物质的电子式是______________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是_______________(填字母)。
A、最高价氧化物对应水化物的酸性 B、气态氢化物的沸点
C、单质与氢气反应的难易程度 D、其两两组合形成的化合物中元素的化合价
(5)上述反应中,如1.5mol还原剂________(填“得到”或“失去”)________ mol电子,则生成_________ g还原产物。
-
“一硫二硝三木炭”描述的是我国四大发明之一的黑火药配方,黑火药爆炸时发生的反应为S+2KNO3+3C  K2S+N2↑+3CO2↑,对于该反应说法不正确的是
K2S+N2↑+3CO2↑,对于该反应说法不正确的是
A. 氧化产物是CO2
B. 爆炸的原因是反应释放大量热,并生成大量气体
C. 反应中有三种元素的化合价发生变化
D. 氧化剂与还原剂的物质的量之比为1:3
-
黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S═K2S+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的第一电离能从大到小依次为___________________________;
(2)生成物中,A 的电子式为____________;含极性共价键的分子的中心原子轨道杂化类型_____________;
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(4)S的基态原子价层电子排布式为___________,S的一种化合物ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0pm,密度为________g·cm3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________pm。

-
我国的四大发明之一黑火药, 爆炸时的主要反应是:S +2KNO3 +3C=K2S +3CO2↑+N2↑,下列说法不正确的是
A. 每生成 0.5 mol N2, 反应中转移 6 mol 电子
B. 硝酸钾、 硫磺在黑火药爆炸的反应中是氧化剂
C. KNO3 有强氧化性, 乘坐汽车、 火车、 飞机时不能随身携带
D. 上述反应的生成物都是无毒的, 所以燃放爆竹时不会污染环境
-
黑火药是我国四大发明之一,黑火药爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑其中作为氧化剂的是
A. KNO3 B. C C. KNO3和S D. KNO3 和C
-
下列古代发明与所给化学变化对应错误的是
| 选项 | 古代发明 | 化学变化 |
| A | 生产陶瓷 | SiO2 + CaCO3 CaSiO3+ CO2↑ CaSiO3+ CO2↑ |
| B | 黑火药爆炸 | S +2KNO3 +3C  K2S+N2↑+3CO2↑ K2S+N2↑+3CO2↑ |
| C | 湿法炼铜 | CuSO4+Fe=Cu+FeSO4 |
| D | 用谷物酿酒 | (C6H10O5)n → C6H12O6 → CH3CH2OH |
A. A B. B C. C D. D
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为为:S(s) + 2KNO3(s) + 3C(s) == K2S(s) + N2(g) + 3CO2(g) ΔH= x kJ·mol-1 。已知碳的燃烧热ΔH1 = a kJ·mol-1;S(s) + 2K(s) == K2S(s); ΔH2= b kJ·mol-1;2K(s) + N2(g)+3O2(g)==2KNO3(s); ΔH3= c kJ·mol-1 。则x为( )
A.3a+b-c B.c +3a-b C.a+b-c D.c+a-b
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3 (s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
S(s)+2K(s)═K2S(s)△H2=bkJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=ckJ•mol-1则x为
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。