-
(13分)对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H= +180.5kJ·mol-1;
H= +180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H = -483.6 kJ·mol-1;
H = -483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H = -92.4 kJ·mol-1。
H = -92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
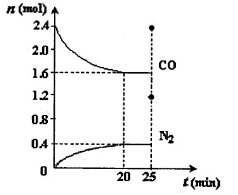
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
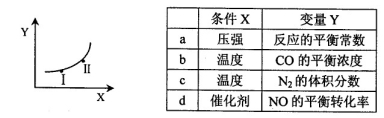
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02×1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
-
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
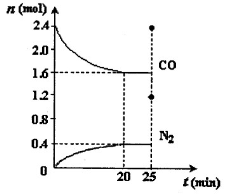
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。

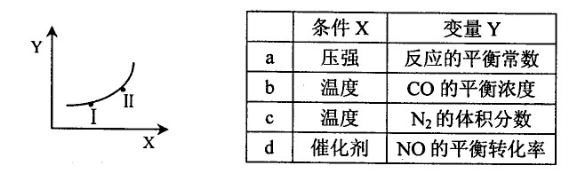
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
-
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 _。
(2)氨气是化工生产的主要原料之一,在一固定容积为2L的密闭容器内加入0.2 mol N2和0.5mol H2,发生如下反应: N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
①当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L 则从反应开始到平衡时,v(N2)为______________
②下列描述中能说明上述反应已达平衡的是
A.容器内的总压强不再随时间而变化
B.混合气体的密度不再随时间变化
C.a molN≡N键断裂的同时,有6amolN—H键生成
D.N2、H2、NH3的分子数之比为1∶3∶2
E.3V正(H2)=2V逆(NH3)
F.容器中气体的平均分子量不随时间而变化
③若保持反应温度不变,再向容器中充入N2和NH3各0.1mol , 则化学平衡将 移动(填“向左”、“向右”或“不”)
④平衡后,下列措施既能提高该反应的速率又能增大N2的转化率的是( )
A.充入N2 B.升高温度 C.向原容器内继续充一定量NH3 D.增大压强
⑤若保持容器体积不变,下列图像正确的是( )

-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)部分氮氧化合物之间的转化所发生的化学反应如下:
I.NO(g)+NO2(g)+O2(g) N2O5(g) △H1=-112.5 kJ·mol-1
N2O5(g) △H1=-112.5 kJ·mol-1
II.2NO(g)+C2(g) 2NO2(g) △H2=-114.2 kJ·mol-1
2NO2(g) △H2=-114.2 kJ·mol-1
①反应2N2O5(g) 4NO2(g)+O2(g)的 △H=________kJ·mol-1
4NO2(g)+O2(g)的 △H=________kJ·mol-1
②反应II的机理为:
第一步:2NO (g) N2O2(g)(快) △H3<0
N2O2(g)(快) △H3<0
第二步:N2O2(g)+O2(g)→2NO2(g)(慢) △H4<0
下列说法正确的是__________(填标号)
A.N2O2是反应的中间体 B.第一步反应的活化能较大
C.第一步、第二步中的碰撞均100%有效 D.整个反应的反应速率由第二步决定
(2)常温常压下,SO2与O2间的反应极慢,但向二者的混合物中加入适量的NO2后,SO2很快就会转化为SO3。反应过程中,反应体系的能量变化可用下图中的某一曲线表示(图中曲线a表示没有使用NO2时的能量变化)。
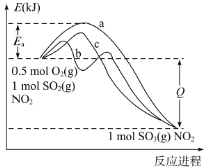
①最可能表示使用了NO2的能量变化曲线是______(填“b”或“c”),Ea表示的意义是_______。
②若维持其他条件不变,用催化剂V2O5代替NO2,下列物理量中不可能变化的是_______(填标号)。
A.反应的活化能 B.反应速率 C.反应热 D.平衡常数K
(3)2L恒容密闭容器中最初存在n(SO2)=4 mol、n(O2)=x mol的混合物,分别在温度为T1、T2条件下发生反应2SO2(g)+O2(g) 2SO3(g) △H<0。控制其他条件不变,改变n(O2),测得平衡时SO3的体积分数[φ(SO3)]与)n(O2)的关系如图所示。
2SO3(g) △H<0。控制其他条件不变,改变n(O2),测得平衡时SO3的体积分数[φ(SO3)]与)n(O2)的关系如图所示。
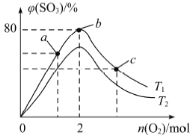
①T1_________T2(填“>”或“<”),a、b、c三点时,SO2转化率最大的是_____________。
②若x=2,计算温度为T1时反应2SO2(g)+O2(g) 2SO3(g)的平衡常数K=____________。
2SO3(g)的平衡常数K=____________。
-
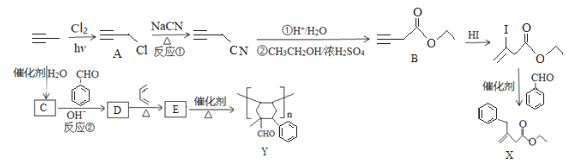
利用丙炔和苯甲醛研究碘代化合物与苯甲醛在 Cr-Ni 催化下可以发生偶联反应和合成 重要的高分子化合物Y的路线如下:
已知:①R1CHO+R2CH2CHO
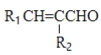 +H2
+H2
②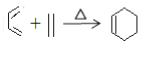
回答下列问题:
(1)A的化学名称为____。
(2)B中含氧官能团的名称是______。
(3)X的分子式为_______。
(4)反应①的反应类型是________。
(5)反应②的化学方程式是_______。
(6)L是D的同分异构体,属于芳香族化合物,与D具有相同官能团,其核磁共振氢谱为5组峰,峰面积比为3:2:2:2:1,则L的结构简式可能为_____。
(7)多环化合物是有机研究的重要方向,请设计由 、CH3CHO、
、CH3CHO、 合成多环化合物
合成多环化合物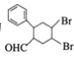 的路线(无机试剂任选)______。
的路线(无机试剂任选)______。
-
在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
| 化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
| N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
| 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
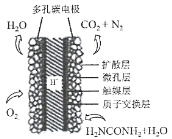
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
-
过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
Ⅰ.对NO与O2反应的研究。
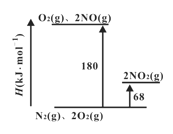
(1)已知氮氧化物转化过程中的焓的变化如下图所示,写出 NO转化为NO2的热化学方程式__________。
(2)2NO+O2 2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
(3)已知:2NO2(g) N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。
N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。
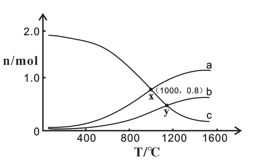
①曲线c代表________的物质的量与温度的关系,x点对应的O2的转化率为________。
②根据上图可推测_________________。
A.2NO+O2 2NO2的平衡常数:x点﹥y点
2NO2的平衡常数:x点﹥y点
B.y点时2NO+O2 2NO2的反应速率:υ(正)﹤υ(逆)
2NO2的反应速率:υ(正)﹤υ(逆)
C.400~1200℃时,随着温度升高,N2O4体积分数不断增大
D.x点对应的NO的物质的量分数为4/11
Ⅱ.对废水中过量氨氮转化的研究。
废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水,将其转化为无污染物质,不同进水pH对氨氮去除率的影响如图所示。
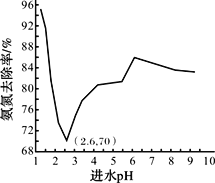
已知:ⅰ.HClO的氧化性比NaClO强;
ⅱ.NH3比NH4+更易被氧化。
(4)pH=1.25时,NaClO与NH4+反应生成N2等无污染物质,该反应的离子方程式______。
(5)进水pH为1.25~6.00范围内,氨氮去除率随pH升高发生图中变化的原因是_______。
-
研究氮及其化合物的性质在人类进步过程中具有极为重要的意义
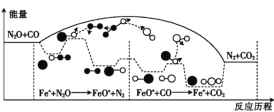
(1)研究表明,CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。由图可知总反应的化学反应速率由反应____(填“①”或“②”)决定。
(2)工业生产可以用NH3(g)与CO2(g)经两步可逆反应生成尿素,两步反应的能量变化示意图如下:
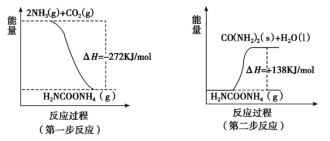
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)基元反应是指反应物直接转化为产物的反应。飞秒激光为代表的分子动力学可测得过程中出现的物质的光谱从而研究反应的机理,反应级数是速率方程中浓度项的幂次之和,用n表示。反应级数越大表示浓度对反应速率影响越大。已知:基元反应N2O5═N2O4+ O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
(4)已知反应:2NO(g)+2H2(g)⇌N2(g)+2H2O(g)在1L密闭容器中进行,该反应达到平衡过程测得下表数据。
| 实验序号 | 温度℃ | 初始NO浓度(mol·L-1) | 初始H2浓度(mol·L-1) | NO的平衡转化率 |
| 1 | 110 | 1.2 | 1.2 | a |
| 2 | 110 | 1.0 | 1.0 | 50% |
| 3 | 100 | 1.0 | 1.0 | b |
①在110 ℃时,此反应的化学平衡常数为________。
②在实验2的平衡体系中再加入1.0mol NO和0.5 mol N2,平衡将向________方向移动。
③实验1中,NO的转化率a________50%(填“>”、“=”或“<”)。实验3中,b的值________(填字母序号)。
A.等于50% B.大于50%
C.小于50% D.由本题所给资料无法判断
(5)一种直接肼燃料电池的结构如图所示,回答下列问题
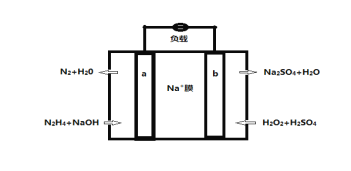
①b为电池的_________极
②负极的电极反应方程式为_________________________________
-
利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S) ,可制取金属铜。
己知反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) △H1=150 kJ/mol
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) △H2=59.5kJ/mol
2H2S(g)=2H2(g)+S2(g) △H3 =170kJ/mol
通过计算,可知用炭还原Cu2S 制取金属铜和CS2(g) 的热化学方程式为_________。
(2)为研究反应2H2S(g) 2H2(g) +S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
2H2(g) +S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S 的转化率与时间的关系如下图所示:
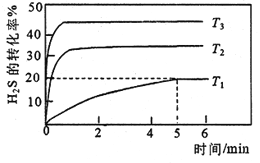
T1温度下,0~5min S2(g)的平均反应速率v(S2)= _____mol.L-1.min-1,反应平衡常数K=_____mol.L-1。温度T1、T2、T3 由高到低的顺序是________。
②T4 温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4______ T1 (填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42- 的物质的量分数(δ) 与pH的关系如下图所示:
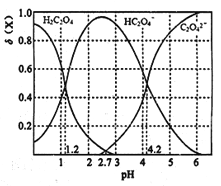
①草酸的电离常数分别为K1与K2,则 =______。
=______。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是____(填序号)。
A. 该溶液的pH为4.2
B. 3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C. 3c(Na+)=5[c(HC2O4-)+c(C2O42-) +c(H2C2O4)]
D. 3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
-
研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
Ⅰ.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) CO(g)+H2(g) ΔH=+131 kJ/mol
CO(g)+H2(g) ΔH=+131 kJ/mol
②CO(g)+3H2(g) CH4(g)+H2O(g) ΔH=a kJ/mol
CH4(g)+H2O(g) ΔH=a kJ/mol
查阅资料反应②中相关化学键键能数据如下表:
| 化学键 | C≡O | H-H | H-C | H-O |
| E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)则反应②中a=______。
(2)煤直接甲烷化反应C(s)+2H2 (g) CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1 mol CO2和2.5 mol H2,发生反应: 2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
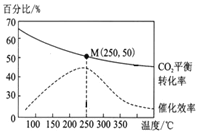
(3)图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是______。
(4)250℃时,该反应的平衡常数K值为______。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入1 molCO2和3 molH2,发生反应:CO2(g)+3H2(g)  CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5)反应前1小时内的平均反应速率v(H2)为______mol/(L·h),该温度下CO2的平衡转化率为______。
Ⅳ.电解逆转化制乙醇
(6)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在______极(填“阴”或“阳”),该电极的反应式为______。
H=+180.5kJ·mol-1;
H =-483.6 kJ·mol-1;
H =-92.4 kJ·mol-1。
N2(g)+2CO2(g)
H<0。


1023个电子,则有标准状况下11.2L电极反应物被氧化






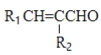 +H2
+H2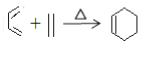
 的路线(无机试剂任选)______。
的路线(无机试剂任选)______。









