-
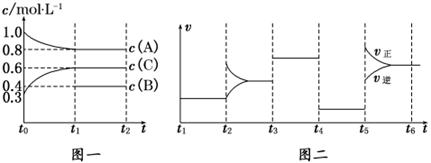
向某密闭容器中加入0.30mol A、0.10mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.如图2为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各只改变一种条件,所改变的条件均不同.已知t3~t4阶段为使用催化剂.

图1 图2
(1)若t1=20s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)= ; t4~t5阶段改变的条件为 ;(t0为坐标原点)
(2)若t2~t3阶段,C的体积分数在不断地变小,则此阶段v(正) v(逆) (填“>”、“=”、“<”); t3~t4的平衡常数K= 。
(3)t5~t6阶段改变的条件为 ;B的起始物质的量为 ;
(4)t1达到平衡后,若保持容器温度和体积不变,再向容器中加入0.08mol A,0.2mol C,则平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(5)在温度和容积不变条件下,能判断该反应达到平衡的依据是
A.混合气体的平均相对分子质量不变 B.反应体系的总压强不变
C.生成2mol C的同时生成3mol A D.2v生成(A)=3v生成(C)
-
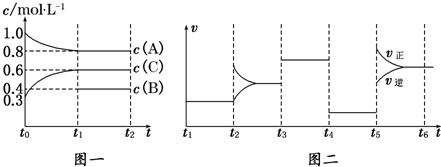
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=_______________.
(2)t4~t5阶段改变的条件为_______________,B的起始物质的量为_______________.
各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1=_______________ (保留两位小数),K1、K2、K3、K4、K5之间的关系为____ (用“>”、“<”或“=”连接).
-
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______________.
(2)t4~t5阶段改变的条件为______________,B的起始物质的量为______________.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______________.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______________.
(5)容器乙与容器甲的体积相同且保持不变,且乙容器的温度恒定为甲容器t4~t5时的温度,若要使C的平衡浓度为1.2mol/L,则在乙容器中加入1.2molA、0.6molB的同时还需要加入___________molC。
-
向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是( )
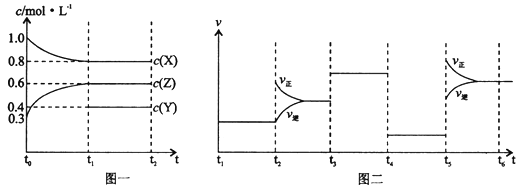
A. Y的起始物质的量为0.5 mol
B. 该反应的化学方程式为:2X(g)+Y(g)  3Z(g) ∆H<0
3Z(g) ∆H<0
C. 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D. 反应物X的转化率t6点比t3点高
【答案】B
【解析】试题t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中X的浓度变化为1mol/L-0.8mol/L=0.2mol/L,Z的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则X、Z的化学计量数之比为2:3,该反应为气体体积不变的反应,则Y为反应物,该反应为2X(g)+Y(g) 3Z(g),t5时为升高温度,平衡正向移动,说明正反应∆H>0。A.X减少0.2mol/L,则Y减少0.1mol/L,则起始Y的浓度为0.1mol/L+0.4mol/L=0.5mol/L,起始物质的量为0.5mol/L×2L=1mol,故A正确;B.由上述分析可知,此温度下该反应的化学方程式为2X(g)+Y(g)
3Z(g),t5时为升高温度,平衡正向移动,说明正反应∆H>0。A.X减少0.2mol/L,则Y减少0.1mol/L,则起始Y的浓度为0.1mol/L+0.4mol/L=0.5mol/L,起始物质的量为0.5mol/L×2L=1mol,故A正确;B.由上述分析可知,此温度下该反应的化学方程式为2X(g)+Y(g) 3Z(g)∆H>0,故B错误;C.若t0=0,t1="10" s,则t0~t1阶段的平均反应速率为v(Z)=
3Z(g)∆H>0,故B错误;C.若t0=0,t1="10" s,则t0~t1阶段的平均反应速率为v(Z)= =0.03 mol/(L·s),故C正确;D.t3为使用催化剂,平衡不移动,t5时为升高温度,平衡正向移动,反应物X的转化率t6点比t3点高,故D正确;故选B。
=0.03 mol/(L·s),故C正确;D.t3为使用催化剂,平衡不移动,t5时为升高温度,平衡正向移动,反应物X的转化率t6点比t3点高,故D正确;故选B。
考点:考查了化学平衡图像、化学平衡的影响因素的相关知识。
【题型】单选题
【结束】
18
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A. 7.8g过氧化钠含有的共用电子对数为0.2NA
B. 2H2O2(l)=2H2O(l)+O2(g)ΔH=−98.2 kJ/mol,ΔS=70.5 J/mol·K,该反应低温能自发进行
C. 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D. 在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
【答案】B
【解析】
A.过氧化钠的电子式为 ,则7.8g过氧化钠含有的共用电子对为
,则7.8g过氧化钠含有的共用电子对为 ×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2 kJ•mol-1,△S=70.5 J•mol-1•K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2 kJ•mol-1,△S=70.5 J•mol-1•K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
【题型】单选题
【结束】
19
常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A. b点溶液中离子浓度由大到小的顺序为: c(Na+)>c(SO42—)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d 三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42—)+c(OH-)
-
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。

(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)=________mol/(L∙s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正________v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为________mol;
(4)t1时刻,平衡常数K=________;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式________;
(6)若t2时刻后图像变化如下图,则改变条件为
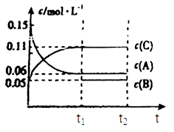
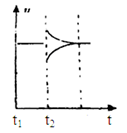
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
-
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示。图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图甲中t0~t1阶段c(B)未画出。
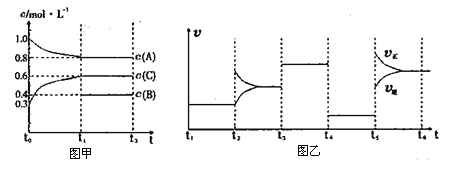
下列说法不正确的是
A. 该反应为吸热反应
B. B 在t0~t1阶段的转化率为60%
C. t4~t5阶段改变的条件为减小压强
D. 此温度下该反应的化学平衡常数K=0.84
-
向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
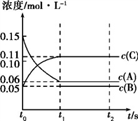
(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
-
向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
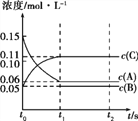
(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
-
向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
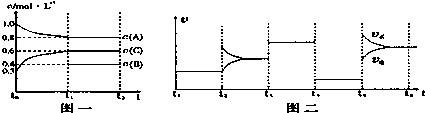
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=___________.
(2)t4-t5阶段改变的条件为____________,B的起始物质的量为____________。各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
K1、K2、K3、K4、K5之间的关系为____________(用“>”、“<”或“=”连接)。
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式____________。
-
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体,在一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示。图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段使用了催化剂;图甲中t0~t1阶段c(B)的变化情况未画出。
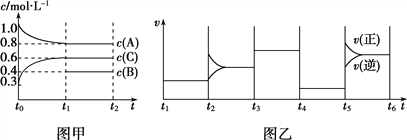
下列说法不正确的是( )
A. 该反应为吸热反应 B. B在t0~t1阶段的转化率为60%
C. t4~t5阶段改变的条件为减小压强 D. t1时该反应的化学平衡常数K=












