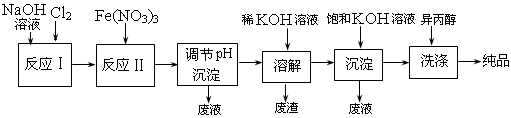-
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向.
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是______.
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定.反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:
(2)①写出反应①的离子方程式______
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)______Ksp(Na2FeO4)(填“>”或“<”或“=”).
(3)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O⇌4Fe(OH)3↓+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是______.
(4)FeO42-在水溶液中的存在形态图如下图所示.
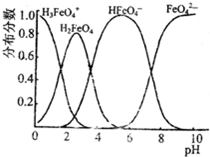
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是______.
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,______转化为______(填化学式).
-
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是________。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
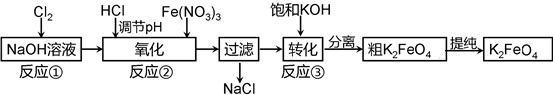
主要的生产流程如下:
①写出反应①的离子方程式。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是________。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是________。
(4)FeO42—在水溶液中的存在形态图如图所示。
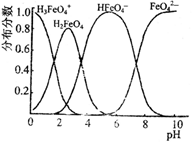
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,________转化为________(填化学式)。
-
高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
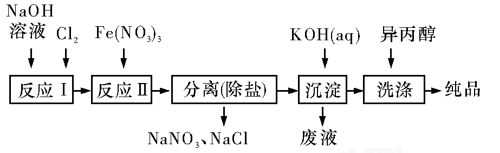
洗涤粗品时选用异丙醇而不用水的理由是:_____________。
反应Ⅱ的离子方程式为__________________________。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_____________时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知_____________(填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为_____________。
(4)与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为_____________,该电池总反应的离子方程式为_____________。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
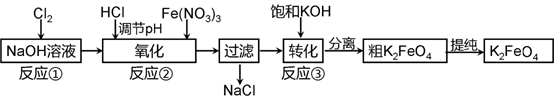
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
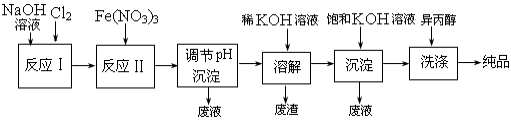
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③进行溶解,沉淀、洗涤这些操作的共同目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为________________。
(3)湿法、干法制备K2FeO4的反应中均利用的是+3价Fe元素的 性质。
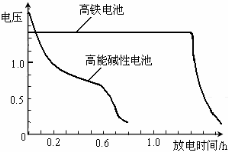
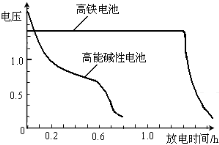
(4)高铁电池是正在研制中的可充电干电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
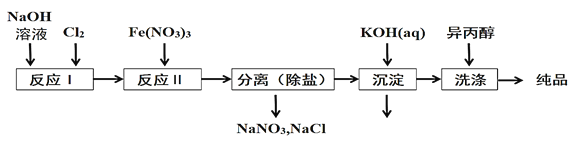
①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为___________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______它能净水的原因是_______。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____(填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
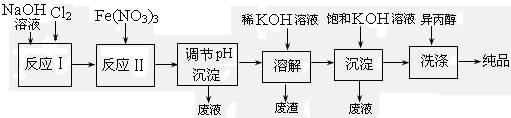
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水
 的原理为________,__________。
的原理为________,__________。
(3)干法制备K2FeO4的反应中,氧化剂与
还原剂的物质的量之比为 。
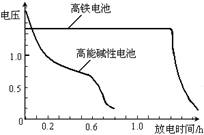
(4)高铁电池是正在研制中的可充电干电池,
右图为该电池和常用的高能碱性电池的
放电曲线,由此可得出的高铁电池的优
点有 、 。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
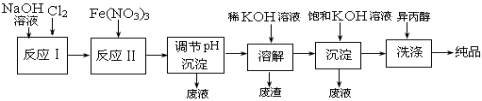

①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。
-
(12分) 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
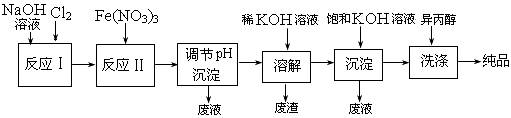
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
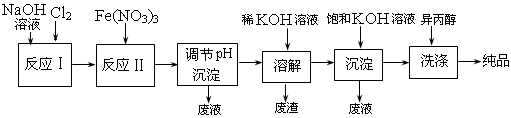
①反应I的化学方程式为 ________ 。
②反应II的离子方程式为 ________ 。
③加入饱和KOH溶液的目的是 ________ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ________ ; __________________。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
-
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:

①反应I的化学方程式为 ▲ 。
②反应II的离子方程式为 ▲ 。
③加入饱和KOH溶液的目的是 ▲ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为▲ ,____▲______。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 ▲ 。
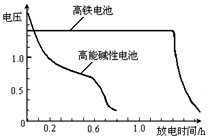
(4)高铁电池是正在研制中的可充电干电池,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
-
研究证明高铁酸钠 是一种“绿色环保高效”消毒剂,比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良。高铁酸钠只能在碱性环境中稳定存在。下列是通过次氯酸钠氧化法制备高铁酸钠并探究其性质的实验,步骤如下:
是一种“绿色环保高效”消毒剂,比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良。高铁酸钠只能在碱性环境中稳定存在。下列是通过次氯酸钠氧化法制备高铁酸钠并探究其性质的实验,步骤如下:
Ⅰ 用氯气和氢氧化钠溶液反应制备NaClO溶液
用氯气和氢氧化钠溶液反应制备NaClO溶液
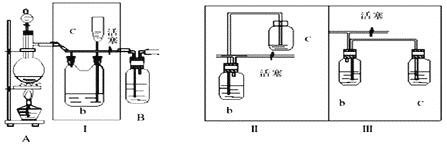
(1) 是氯气发生装置,写出实验室用此装置制取氯气的离子方程式___________。
是氯气发生装置,写出实验室用此装置制取氯气的离子方程式___________。
(2)Ⅰ装置的作用是__________。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行?___________。简要说明理由_________________________。
(4)将产生的氯气通入D装置中制NaClO溶液
已知: 为了防止产生
为了防止产生 ,除搅拌和混入
,除搅拌和混入 稀释外,还应采取的操作是___________________________。
稀释外,还应采取的操作是___________________________。
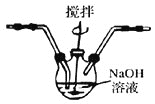
Ⅱ 制备
制备
(1)将 溶液加入到NaOH与NaClO的混合溶液中,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品,上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是______________________________。
溶液加入到NaOH与NaClO的混合溶液中,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品,上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是______________________________。
(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池反应的化学方程式_______________________。

4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是________。








 的原理为________,__________。
的原理为________,__________。