-
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测________推(计)算反应速率。
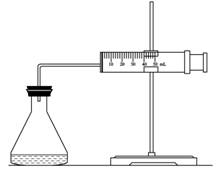
(2)为实现实验目的,则V1=________,V2=________;
V3=________,V4=________。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是________(填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O。
-
下面是某研究小组研究的关于不同催化剂对H2O2 分解反应的催化效率。
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(1)写出H2O2 在催化剂作用下分解反应的化学方程式________________________
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是_____________________,
等质量的固体催化剂,颗粒大小对催化效率有什么影响______________________
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入
盐酸,或给溶液加热时,就会失去催化能力,合理的解释是________
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一
个实验进行验证。_______________________________________________________
-
(10分)下面是某研究小组研究的关于不同催化剂对H2O2 分解反应的催化效率。
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(1)写出H2O2 在催化剂作用下分解反应的化学方程式______________________________
(2)从上表可以得出:
活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是__________
等质量的固体催化剂,颗粒大小对催化效率有什么影响__________________________
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一个实验进行验证。
___________________________________________________________
-
在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
| 反应物 | 催化剂 | 温度 |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |
通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
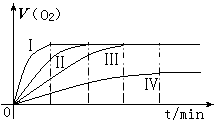
(1)代表实验①的图示是________________。
(2)对比实验③和④的目的是_____________。
(3)通过上面对比实验,所得的实验结论是_______。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:
2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:

(4)从开始反应到t2时刻,氨气的平均反应速率为_____________。
(5)在t3时刻,氢气的转化率为_________。
-
某研究小组研究不同催化剂对2 L相同浓度H2O2溶液分解反应的催化效果时所得实验结果(O2体积均换算为标准状况下,忽略反应前后体积变化)如表,下列说不正确的是:
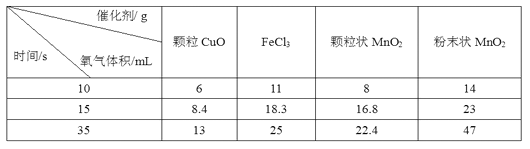
A. 在15~35 s内,FeCl3的催化作用比颗粒状MnO2好
B. 固体催化剂的颗粒大小对反应的催化作用没有影响
C. 催化效率由大到小的顺序:粉末状MnO2 、FeCl3、颗粒CuO
D. 在颗粒状MnO2催化作用下,0~15 s内v(H2O2)=5.0×10-5 mol·L-1 ·s-1
-
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
A.5 mL 2% H2O2溶液 B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液 D.5 mL 10% H2O2溶液
-
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
A. 5 mL 2% H2O2溶液 B. 10 mL 2% H2O2溶液
C. 10 mL 5% H2O2溶液 D. 5 mL 10% H2O2溶液
-
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
A.5 mL 2% H2O2溶液 B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液 D.5 mL 10% H2O2溶液
-
某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2 溶液 | 无 |
| ② | 10 mL 5% H2O2 溶液 | 无 |
| ③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol • L-1 FeCl3 溶液 |
| ④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol • L-1 FeCl3 溶液 |
| ⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol • L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
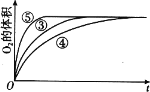
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
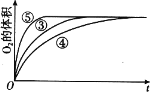
-
某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2 溶液 | 无 |
| ② | 10 mL 5% H2O2 溶液 | 无 |
| ③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol • L-1 FeCl3 溶液 |
| ④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol • L-1 FeCl3 溶液 |
| ⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol • L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。