-
常温下,有下列四种溶液:
①
②
③
④
0.1mol/L 盐酸
pH = 3盐酸
0.1mol/L 氨水
pH = 11氨水
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
1825℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN)
碳酸(H2C03)
氢氟酸(HF)
K=4.9×10﹣10
K1=4.4×10﹣7
K2=4.7×10﹣11
K=6.61×10﹣4
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
高二化学单选题中等难度题查看答案及解析
-
常温下,有下列四种溶液:
①
②
③
④
0.1mol/L 盐酸
pH = 3盐酸
0.1mol/L 氨水
pH = 11氨水
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
1825℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN)
碳酸(H2C03)
氢氟酸(HF)
K=4.9×10﹣10
K1=4.4×10﹣7
K2=4.7×10﹣11
K=6.61×10﹣4
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
高二化学单选题中等难度题查看答案及解析
-
常温下,有下列四种溶液:
①
②
③
④
0.1mol/L 盐酸
pH = 3盐酸
0.1mol/L 氨水
pH = 11氨水
下列说法正确的是
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D.②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
高二化学选择题中等难度题查看答案及解析
-
常温下,下列溶液一定呈碱性的是
A.pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合
B.0.1mol·L-1盐酸和0.1mol·L-1氨水等体积混合
C.0.1mol·L-1氨水和0.1mol·L-1氯水铵溶液等体积混合
D.一定体积pH=5的稀硫酸加水稀释103倍
高二化学选择题中等难度题查看答案及解析
-
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
氨水浓度/mol·L-1
盐酸浓度/mol·L-1
混合溶液pH
①
0.1
0.1
pH=5
②
c
0.2
pH=7
③
0.2
0.1
pH>7
请回答下列问题:
(1)①中所得混合溶液c(OH-)=______ mol·L-1。
(2)②中,c______0.2(填“>”“<”或“=”)。
(3)③中所得混合溶液,各离子浓度由大到小的顺序是_______。
(4)①、③所用氨水中的
:①_______③(填“>”“<”或“=”)。
高二化学综合题中等难度题查看答案及解析
-
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水________氢氧化钠(填“<” 、“=” 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性,________消耗的盐酸多。反应生成的氯化铵溶液呈________(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)________
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置。可以观察到的现象是________,产生该现象的原因是(用离子方程式和简要文字表达)________
高二化学填空题简单题查看答案及解析
-
常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是

A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
高二化学单选题中等难度题查看答案及解析
-
常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是

A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
高二化学单选题中等难度题查看答案及解析
-
常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是

A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
高二化学单选题中等难度题查看答案及解析
-
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: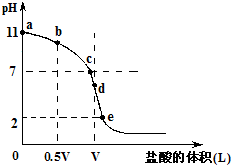
(1)氨水的电离方程式为______,该温度时氨水的电离平衡常数K=______.
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为______.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有______.
A.c(H+)•c(OH-) B.C.
D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)______.
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=______,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为______.高二化学解答题中等难度题查看答案及解析