-
(1)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液) 灭火时发生反应的离子方程式:_______________。
(2)常温下若溶液由pH=3的HA溶液V1mL 与pH=11的NaOH溶液V2mL混合而得正确的有_______________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mo/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某温度时,测得0.01mol·L-1 的NaOH溶液的pH为10。若将此温度下pH=10的NaOH 溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=_______。
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,滴定时应选用适当的指示剂,判断该滴定终点的现象为(必须描述颜色的变化)______________________。
②A、B、C三点所示溶液导电能力最强的是___________点对应的溶液;
③比较A、C两点中水的电离程度:A_______C (填“>”、“ =”或“<”)。
(6)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________mol/L。[Fe(OH)3的Ksp=2.6×10-39]
-
根据题目要求回答下列各小题:
(1)泡沫灭火器中装有硫酸铝和碳酸氢钠溶液,二者混合时发生剧烈反应,请写出灭火时发生 反应的离子方程式:
反应的离子方程式: 
(2)请写出明矾[K Al(SO4)2 .12 H2O]做净水剂净水时的离子方程式
(3)利用纯碱溶液的碱性可以去除油污,呈碱性的原因是(填离子方程式):
(4)物质的量浓度相同的 ①氯化铵;② 碳酸氢铵;③ 硫酸氢铵; ④硫酸铵4种溶液中,c(NH4+)由大到小的顺序是_____ (填写序号)
-
(1)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生反应的离子方程式: 。
(2)物质的量浓度相同的 ①氯化铵;②碳酸氢氨;③硫酸氢氨; ④硫酸氨4种溶液中,c(NH4+)由大到小的顺序是 。
(3)请写出明矾(K Al(SO4)2•12 H2O)做净水剂净水时的离子 方程式 。
方程式 。
-
请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生反应的离子方程式: __________________
物质的量浓度相同的 ①氯化铵;② 碳酸氢铵;③ 硫酸氢铵; ④硫酸铵4种溶液中,c(NH4+)由大到小的顺序是_________________
-
(1)常温下pH=5 HCl溶液和pH=5的AlCl3溶液中由水电离产生的c (H+) 之比等于________ 。
(2)写出泡沫灭火器灭火时发生反应的离子方程式________。
(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有 种微粒,各离子浓度从大到小的顺序为________。
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(忽略溶液混合时的体积变化)。
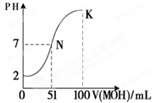
回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”) ② K点对应的溶液中c(M+)+c(MOH)=________mol·L-1。
-
按要求完成下列填空:
(1)将AlCl3溶液加热蒸干并灼烧可得到 (填化学式)。
(2)盛放纯碱溶液的试剂瓶不能用玻璃塞,是因为 。
(3)泡沫灭火器灭火时发生反应的离子方程式是 。
(4)常温下将0.01molCH3COONa和0.02molHCl溶于水,配成0.5L混合溶液。溶液中共有 种粒子,各离子浓度从大到小的顺序为 。
-
书写下列化学用语:
(1)氯碱工业中电解饱和食盐水总反应的离子方程式________。
(2)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,用离子方程式表示泡沫灭火器的灭火原理________。
(3)向含有Mg(OH)2固体的浊液中加入浓NH4Cl溶液,Mg(OH)2固体溶解,用化学方程式解释原因________。
(4)以甲烷、空气为燃料,以KOH为电解质溶液的燃料电池,负极反应式________,正极反应式________。
(5)用惰性电极电解溶融Al2O3可以获得活泼金属Al,写出阳极的电极反应式________,总反应的化学方程式________。
-
(l4分)(1)①常温下,0.01mol/L的二元酸H2A溶液的pH=5,其电离方程式为________。
②用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。
③ 比较0.1mol/L的下列各种溶液的pH大小:
CH3COONa___________NaClO;CuSO4_________KHCO3。(填“>”、“<”或“=”)
(2) 25℃时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。试回答以下问题:
①混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合物中下列算式的计算结果(填具体数字):
c(A-)+c(HA)=________mol/L; c(OH-)-c(HA)=________mol/L。
-
普通泡沫灭火器的铁筒里装着一只小玻璃筒,玻璃筒内盛装硫酸铝溶液,铁筒里盛装碳酸氢钠饱和溶液。使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡沫。
(1)产生此现象的离子方程式是____________________________。
(2)不能把硫酸铝溶液装在铁筒里的主要原因是__________ ___。
(3)一般不用碳酸钠代替碳酸氢钠,是因为____________________________。
-
完成下列各问题
(1)泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:________;
(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出①电荷守恒__________________;②物料守恒______________________;③质子守恒______________________________;④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)______。

