-
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.恒温下,往一个4L的密闭容器中充人2molN2和5.2molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①5min内,消耗H2的平均反应速率为________时间/min 5 10 15 20 25 30 c(NH3)/mol•L-1 0.08 0.14 0.18 0.20 0.20 0.20
②N2的平衡转化率________
③计算此条件下该反应的化学平衡常数K=________.
④若维持容器体积不变,只升高温度化学平衡常数值________(填变大、变小、不变),正反应速率________(填变大、变小、不变).
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度________0.4mol•L-1(填大于、小于、等于)
⑥若维持容器体积不变,充入He使之压强增大一倍,正反应速率________(填变大、变小、不变),若维持压强不变,充入He,则平衡移动方向为________(填正移、逆移、不移)高二化学填空题中等难度题查看答案及解析
-
运用化学反应原理对研究部分单质及其化合物的反应有重要意义。
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)
2NH3(g)。请回答:
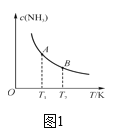
①已知H—H键键能为436kJ·mol-1,N≡N键键能为945 kJ·mol-1,N—H键键能为391 kJ·mol-1。由键能计算消耗1 mol N2时的ΔH=_____。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡____(填“向左”、“向右”或“不”)移动。
②如图中,当温度由T1变化到T2时,KA___(填“>”、“<”或“=”)KB。
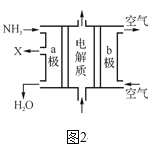
③废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作____(填“正”、“负”、“阴”或“阳”)极,其电极反应式为____。
(2)某温度下在容积固定的密闭容器中,下列反应达到平衡:CO(g)+H2O(g)
CO2(g)+H2(g)
起始n(CO)∶n(H2O)
CO转化率
H2O转化率
1∶1
0.5
0.5
1∶2
0.67
0.33
1∶3
0.75
0.25
①该反应的平衡常数为_____。该温度下,向容器中充入1 mol CO、3 mol H2O、2 mol CO2、1.5 mol H2,则起始时该反应速率v(正)______(填“>”、“<”或“=”)v(逆)。
②结合表中数据,判断下列说法正确的是_______(填字母)。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1∶4时,CO的转化率为0.85
③该温度下,向容器中充入2 mol CO、2 mol H2O,达平衡时放出a kJ热量,则该反应的ΔH=_____。
高二化学综合题困难题查看答案及解析
-
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。 合成氨反应: N2(g)+3H2(g)
2NH3(g) △H
(1)若该反应在一定条件下能自发,则该反应的△H________0、△S________0(填“<”、“>”或“=”)。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是________。
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)=,该温度下的平衡常数K=________。若升高温度,K值变化________(填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表的①②处填入合适的实验条件数据。
实验编号
T(℃)
n (N2)/n(H2)
P(MPa)
平衡时NH3百分含量
ⅰ
450
1/3
1
ⅱ
①
1/3
②
________
ⅲ
480
1/3
10
高二化学填空题简单题查看答案及解析
-
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
合成氨反应:N2(g)+3H2(g)2NH3(g)△H
(1)若该反应在一定条件下能自发,则该反应的△H______0、△S______0(填“<”、“>”或“=”).
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是______.
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成n mol N2的同时生成2n molNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)=______,该温度下的平衡常数K=______.若升高温度,K值变化______(填“增大”、“减小”或“不变”).
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表的①②处填入合适的实验条件数据.实验编号 T(℃) n (N2)/n(H2) P(MPa) 平衡时NH3百分含量 ⅰ 450 1/3 1 ⅱ ① 1/3 ② ⅲ 480 1/3 10 高二化学解答题中等难度题查看答案及解析
-
Ⅰ、已知:N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min
5
10
15
20
25
30
c(NH3)/mol·L—1
0.08
0.14
0.18
0.20
0.20
0.20
(1)此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正____________v(N2)逆(填写“>”、“=”或“<”=)。
(2)若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡可能正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是增大了容器的体积
Ⅱ、已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
(2)若上述关系中C是正确的,则溶液中溶质的化学式是______________
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)______c(Cl-)。
高二化学综合题中等难度题查看答案及解析
-
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436kJ·mol—1,
键能为945kJ· mol—1,N—H键能为391kJ·mol—1。写出合成氨反应的热化学方程式:
高二化学填空题简单题查看答案及解析
-
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为946kJ•mol-1,N-H键能为391kJ•mol-1.写出合成氨反应的热化学方程式:______
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①5min内,消耗H2的平均反应速率为______时间/min 5 10 15 20 25 30 c(NH3)/mol•L-1 0.08 0.14 0.18 0.20 0.20 0.20
②N2的平衡转化率______
③此条件下该反应的化学平衡常数K=______.反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向______方向移动(填“正反应”或“逆反应”);化学平衡常数值______(填变大、变小、不变);
④若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度______0.4mol•L-1(填大于、小于与等于)高二化学解答题中等难度题查看答案及解析
-
(10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:________
(2)可逆反应N2 +3H2
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是________
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
时间/min
5
10
15
20
25
30
C(NH3)/mol·L-1
0.08
0.14
0.18
0.20
0.20
0.20
5min内,消耗N2的平均反应速率为________;此条件下该反应的化学平衡常数K=________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向________(填“正反应”或“逆反应”)方向移动。
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:
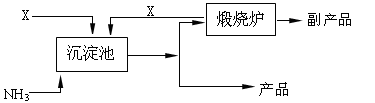
请写出制备(NH4)2SO4的反应方程式:;
并利用有关数据简述上述反应能发生的原因________
高二化学填空题简单题查看答案及解析
-
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
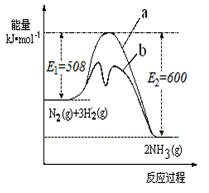
(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号
T(℃)
n (N2)/n(H2)
P(MPa)
ⅰ
450
1/3
1
ⅱ
1/3
10
ⅲ
480
10
高二化学填空题困难题查看答案及解析
-
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据下图提供的信息,写出该反应的热化学方程式
_____________________________________________,
下图的曲线中____________(填“a” 或“b”)表示 加入铁触媒(催化剂)的能量变化曲线。
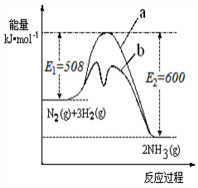
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_________________。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号
T(℃)
n (N2)/n(H2)
P(MPa)
ⅰ
450
1/3
1
ⅱ
______
1/3
10
ⅲ
480
______
10
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g)
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向____________(填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为______________。
高二化学简答题困难题查看答案及解析