-
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
表1
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最强的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是________(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”、“碱性”),溶液中各离子浓度大小的关系是________。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0。0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥________mol·L-1
-
(12分)I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
请回答下列问题:
上述四种酸中,酸性最弱的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
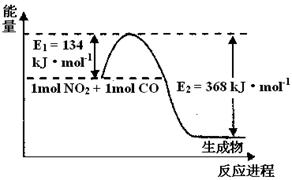
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1.K2的大小,K1_________ K2(填写“>”.“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol.3mol时,则该反应的v(N2)正__________ v(N2)逆(填写“>”.“=”或“<”)
-
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
表1
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是________(用化学式表示).下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是________(填序号).
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”“中性”或“碱性”),理由是:________,溶液中各离子浓度大小的关系是________.
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
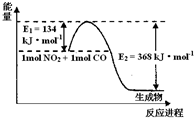
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1_________ K2(填写“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v (N2)正=3v (H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正________v(N2)逆(填写“>”、“=”或“<”).
-
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
表2
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
-
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
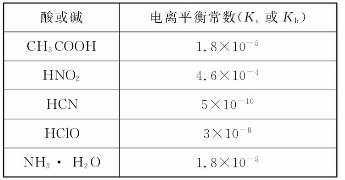
表2
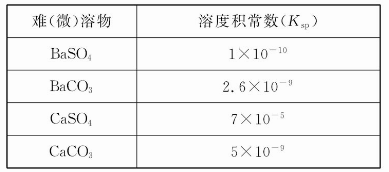
请回答下面问题:
(1)CH3COONH4的水溶液呈 (选填“酸性”、“中性”或“碱性”),理由是 。溶液中各离子浓度大小关系是 。
(2)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为 。
-
已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是__________。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1 HF溶液的pH约等于__________(已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_______(填“酸”、“碱”或“中”)性,并结合有关数据解释原因:_____________。
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。回答下列问题:
①试推断NH4HCO3溶液的pH__________7(填“>”、“<”或“=”);
②将四种溶液按NH4+浓度由大到小的顺序排列是:__________(填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________。
(4)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
-
化学平衡常数 、电离常数
、电离常数 、
、 、溶度积常数
、溶度积常数 等常数是表示判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
等常数是表示判断物质性质的重要常数,下列关于这些常数的说法中,正确的是

A.当温度升高时,弱酸、弱碱的电离常数 、
、 均变小
均变小
B. 说明等物质的量浓度的氢氰酸酸性比醋酸强
说明等物质的量浓度的氢氰酸酸性比醋酸强
C.向氯化钡溶液中加入等体积等浓度的碳酸钠和硫酸钠溶液,先产生 沉淀,则
沉淀,则
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
-
Ⅰ.下表1是室温下,几种弱酸的电离平衡常数(Ka) 和弱碱的电离平衡常数(Kb)
表1
| 酸或碱 | 电离常数(ka或kb) |
| CH3COOH | 1.75×l0-5 |
| 柠檬酸 (H3C6H5O7) | Kal=7.4×l0-4 Ka2=1.73×10-5 Ka3=4.0×l0-7 |
| NH3·H2O | Kb=1.75×l0-5 |
请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是____________
A. 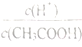 B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. 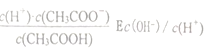
(2)CH3COONH4的水溶液 呈_________(选填“酸性”、“ 中性”、“ 碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7) 溶液显________(填“酸”、“ 中”、“ 碱”)性,通过计算说明其原因____________。
Ⅱ.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。2CO2(g)-6H2(g) CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
| 温度(K) CO2转化率 n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
根据表中数据分析:
①上述反应的α__________0(填“大于” 或“小于”)。
②在一定温度下,提高氢碳(即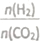 )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
(2) 催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,平衡时,反应产生的热量为wkJ,则w的范围为___________。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是__________________。使用上述乙醇燃料电池电解(Pt 电极)一定浓度的Na2CO3溶液,原理如图所示。阳极的电极反应式为____________________,阴极产生的物质A 的化学式为____________________。
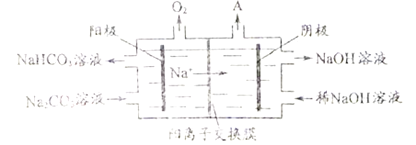
-
下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
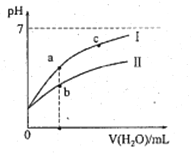
| 弱酸的电离平衡常数(25℃) |
| CH3COOH | HClO |
| Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)
-
下表为25℃时某些弱酸的电离平衡常数;图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
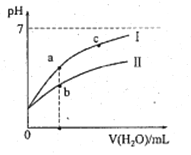
| 弱酸的电离平衡常数(25℃) |
| CH3COOH | HClO |
| Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH- )+c(CH3COO-) > NaClO溶液的c(OH-)+c(C1O-)




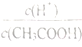 B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. 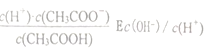
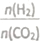 )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。


