-
硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
已知:Na2S、Na2CO3、Na2SO3、NaHCO3溶液呈碱性;NaHSO3溶液呈酸性。
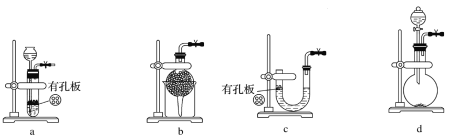
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填字母代号)。
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_____________________________________;
②当浅黄色沉淀不再增多时,反应体系中有无色无味的气体产生,反应的化学方程式为________________________________;
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入过量的SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为________________________。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是________________。
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:

下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
-
Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:___,该反应中,Na2O2的作用为___(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
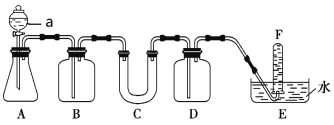
装置A是CO2气体的发生装置,请写出仪器a的名称___,B中盛饱和NaHCO3溶液,其作用是___。写出C中过氧化钠与二氧化碳反应的化学方程式___。D中盛放的试剂可以是____(填序号)。
①浓H2SO4 ②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)___(填离子符号)。
-
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C  2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成2 mol AlN需转移6 mol电子
C. AlN中氮元素的化合价为+3
D. AlN的摩尔质量为41 g
-
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C  2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成2 mol AlN需转移6 mol电子
C. AlN中氮元素的化合价为+3
D. AlN的摩尔质量为41 g
-
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可 通过反应:
通过反应:
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )。
2AlN+3CO合成。下列叙述正确的是( )。
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质 量为41 g
量为41 g
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子[]
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
-
氮化铝具有耐高温、抗冲击、导热性好等优良性能,在电子工业、陶瓷工业等领域有广泛应用。其合成反应为:Al2O3+N2+3C=2AlN+3CO 下列说法不正确的是:
A. C作还原剂,在反应中被氧化 B. 每转移2mol电子时,可产生1mol CO
C. N2作氧化剂,AlN是还原产物 D. 欲制得2molAlN, 消耗N2体积为22.4L
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物

