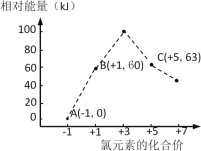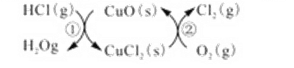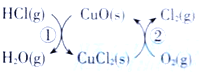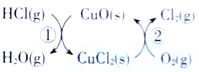-
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:
完成下列填空:
(1).该反应化学平衡常数K的表达式为 ;
实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是 反应(填“吸热”或者“放热”)。
(2).上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: 。
(3).该反应在P0、320C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)= mol。
(4).对该反应达到平衡后,以下分析正确的是 (选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5).氯元素能形成多种离子。在水溶液中1molCl–、1mol ClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示) ;若有1.5molB发生反应,转移电子 mol。

-
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2+4HCl 2Cl2 +2H2O。
2Cl2 +2H2O。
完成下列填空:
(1)该反应化学平衡常数K的表达式为___;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是___反应(填“吸热”或者“放热”)。
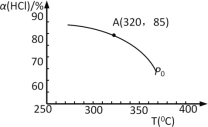
(2)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线___,并简要说明理由:___。
(3)该反应在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)=___mol。
(4)对该反应达到平衡后,以下分析正确的是___(选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5)氯元素能形成多种离子。在水溶液中1molCl-、1molClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的化学方程式(用离子符号表示)___;若有1.5molB发生反应,转移电子___mol。
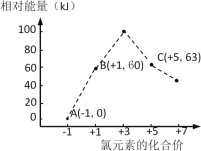
-
用O2将HCl转化为Cl2,可提高效益,减少污染,
新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由___。
-
(16分)用O2将HCl转化为Cl2,可提高效益,减少污染,
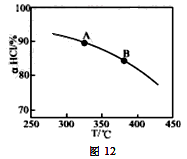
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s) H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
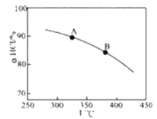
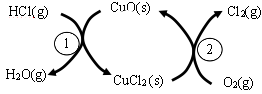
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H 0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。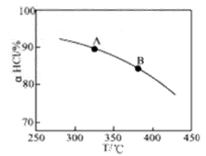
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由 。
③下列措施中有利于提高aHCl的有 。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率 (以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式 。
-
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如右图所示的催化剂循环实现,其中,反应①为:2HCl(g) + CuO(s)  H2O(g)+CuCl2(g) △H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
H2O(g)+CuCl2(g) △H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图12,则总反应的△H 0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T(HCl的转化率与温度的关系)曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高aHCl的有 。
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
2.0~6.0min内以HCl的物质的量变化表示的反应速率 (以mol·min-1为单位)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式。
-
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,
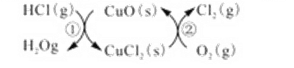
其中,反应①为:2HCl(g) + CuO(s) H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。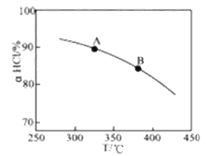
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。
-
(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s)  反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为 ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含 和
和 的代数式表示)。
的代数式表示)。
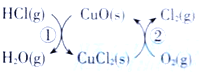
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) ⇌2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的 ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为 ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L ·s
·s 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
-
(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s)  反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为 ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含 和
和 的代数式表示)。
的代数式表示)。
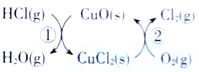
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) ⇌2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的 ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为 ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L ·s
·s 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
-
用O2将HCl转化为Cl2,可提高效益,减少污染,(1)传统上该转化通过如右图所示的催化剂循环实现,
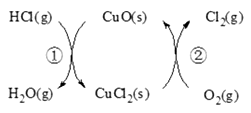
其中,
反应①为2HCl(g)+CuO(s) H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1 mol Cl2的反应热为△H2,则总反应的热化学方程式为_______________________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl-T曲线如图所示,则总反应的△H_____0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______________。

②在上述实验中若压缩体积使压强增大,画出相应ɑHCl~T曲线的示意图,并简要说明理由__________。
(3)①下列措施中有利于提高ɑHCl的有_____________。
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
②一定条件下测得反应过程汇总n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内以HCl的物质的量变化表示的反应速率为_______________(以mol·min-1为单位)。
(4)Cl2用途广泛,写出Cl2制备漂白粉的化学方程式__________________________________。
-
I.用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如图所示的催化剂循环实现,
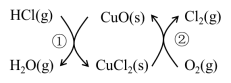
其中,反应①为:2HCl(g) + CuO(s) H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(反应热用△H1和△H2表示)。
II.氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s) + SO2(g)=ZnSO3(s),试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②_______________________;
(2)已知:纯ZnO的悬浮液pH约为6.8。用氧化锌吸收法脱去烟气中SO2的过程中,测得pH、吸收效率η随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。

①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;
④为提高SO2的吸收效率η,可采取的措施为___________。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(3)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
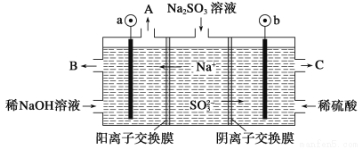
b极的电极反应式为____________________。