-
[化学——选修3:物质结构与性质](15分)前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
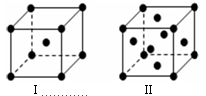
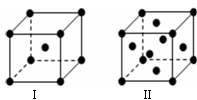
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
-
【化学–选修3:物质结构与性质】(15分)前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F 两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
-
【化学——选修3:物质结构与性质】(15分)X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
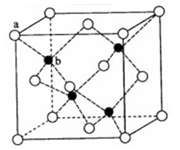
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。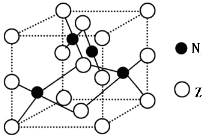
-
[化学——选修3:物质结构与性质] X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列。回答下列问题(若需表示具体元素必须用相应的元素符号):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_____________(用元素符号表示),Y的最简单气态氢化物在水中的溶解度远大于X的最简单气态氢化物,主要原因是____________。
(2)R元素基态原子的电子排布式为_______。Z、M形成化合物M2Z2的电子式为_________。
(3)X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是_________,提供孤对电子的是__________________(填化学式)。
(4)已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石。该化合物的化学式为_____,其晶体类型为______,晶体中X、Y两种元素原子的杂化方式均为___________。
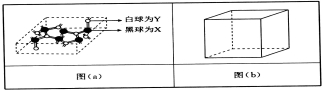
(5)在图(b)中标出R晶体中R原子的位置,该晶体中R原子直径为a pm,R的相对原子质量为M,阿伏加德罗常数为NA,该晶胞密度表达式为___________g·cm-3(用a,M,NA表示)。
-
【化学—选修3:物质结构与性质】
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子,L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是_______________,该原子核外电子排布式是_______________,其最高正价氧化物对应的水氧化物的化学式是_______________;
(2)元素X与Y形成的化合物晶体类型是晶体_________,1mol该化合物含有的化学键数为___________(用阿伏加德罗常数NA 表示);
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是________,该化合物中X的原子的杂化轨道类型是____________;
(4)X与碳、氢、三种元素形成的相对分子质量最小的分子里有个____δ键,____个π键;
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为______。
-
【化学——选修3:物质结构与性质】(15分)
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为 。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
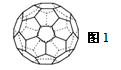
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1molA的这种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示的堆积方式。
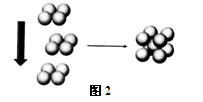
则这种堆积模型的配位数为 ,如果X的原子半径为a cm,阿伏加德常数的值为NA,则计算此单质的密度表达式为 g/cm3(不必化简)。
-
【化学——选修3:物质结构与性质】
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)与T同区、同周期元素原子价电子排布式是 。
(2)E、G、M均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,其中晶胞结构与干冰不一样的是 (填分子式)。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为 (用分子式表示),其中G的最简单氢化物的VSEPR模型名称为 ,M的最简单氢化物的分子立体构型名称为 。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示) 。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因 。
(5)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如下图所示,该晶体的密度为ρ g·cm-3。如果TQ的摩尔质量为M g/mol,阿伏加德罗常数为NA mol-1,则a、b之间的距离为 cm。
-
[化学—选修3:物质结构与性质](15分)
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
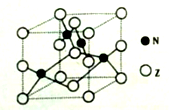
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
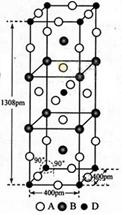
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。
-
[化学—选修3:物质结构与性质]
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
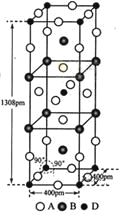
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。
-
[化学—选修3:物质结构与性质]
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
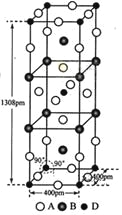
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。










