-
(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下,将足量的SO2气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列最适宜选用的是
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
(3)制备保险粉的化学方程式可表示为
(4)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为 mol。
(5)保险粉不稳定,容易分解生成甲、 乙、 丙三种化合物。若将甲、乙两种物质分别配成溶液,在甲溶液中加入稀硫酸,则有淡黄色沉淀和气体丙产生;乙溶液中加入BaCl2溶液和稀盐酸,有气体丙产生,但无白色沉淀。在甲溶液中加入稀硫酸后所发生反应的离子方程式为 保险粉分解的化学方程式为
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3 或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
高三化学填空题中等难度题查看答案及解析
-
广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:
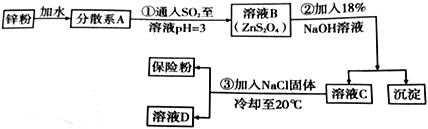
请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
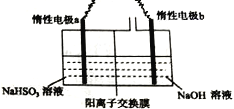
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 mol•L-1Na2S2O4溶液在空气中的pH变化如下图所示;
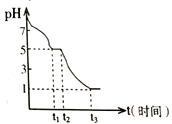
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ mol•L-1(填具体数值,不考虑溶液体积变化)
高三化学实验题困难题查看答案及解析
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫。
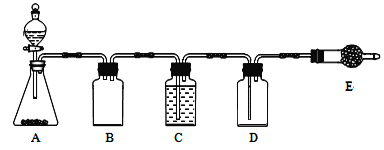
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为____________。
②B装置的作用是_______________________。
③C装置的试剂为__________________,E中固体试剂为________________。
(2)制备保险粉(略)。
(3)测定保险粉纯度。
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O,称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
①滴定时KMnO4溶液装在__________________(玻璃仪器)中。
②滴定终点的标志_______________________________________________________。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为____________(杂质不参与反应)。
高三化学实验题中等难度题查看答案及解析
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫
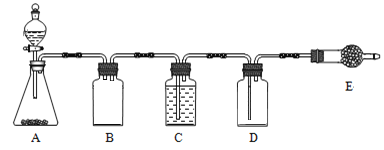
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。
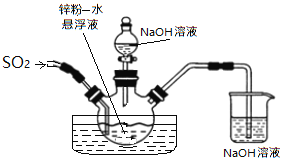
反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
高三化学实验题困难题查看答案及解析
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫
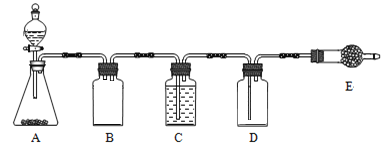
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。
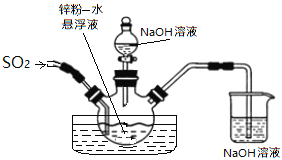
反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
高三化学实验题困难题查看答案及解析
-
常用于印染工业的连二亚硫酸钠(Na2S2O4)俗称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
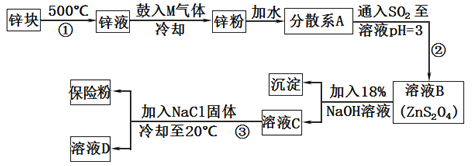
请回答下列问题:
(1)保险粉应如何保存? (填一个注意事项)。
(2)由锌块制备锌粉的目的是 ;向液锌中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm(1m=106μm)的锌粉.鼓入气体M为常见的双原子单质分子,则M的化学式为 ;分散系A为 (填“溶液”“胶体”或“悬浊液”)。
(3)流程②的化学方程式为 。
(4)流程③的分离方法步骤为 、洗涤、干燥,其中洗涤所用试剂是 ;实验室加入NaCl固体的作用是 。
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是② 。
高三化学实验题极难题查看答案及解析
-
Na2S2O4·2H2O是染料工业中常用的还原剂,俗称保险粉。它可溶于氢氧化钠溶液并稳定存在,难溶于乙醇,受热易分解,制备保险粉的流程如下:
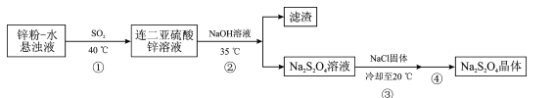
回答下列问题:
(1)保险粉的制备过程要在无氧条件下进行,原因是__________
(2)若用Na2SO3固体和酸反应制备SO2气体,下列最适宜选用的酸是____(填标号)。
A.浓盐酸 B.稀硝酸 C.70%硫酸 D.98%硫酸
(3)步骤②需要控制温度在35℃的原因是__________已知pH>11时,Zn(OH) 2转化为
,为了使Zn2+沉淀完全,则加入氢氧化钠溶液调节溶液的pH范围是______________(25℃时Ksp[Zn(OH)2]=1.0×10‑17,35℃时Ksp与Kw的变化可忽略)。
(4)步骤③中加入一定量NaCl固体的目的是____。
(5)步骤④的操作是__________经干燥得Na2S2O4·2H2O样品。
(6)为了测定Na2S2O4·2H2O样品纯度,取mg样品溶解在足量的甲醛溶液中,配制成100.00mL溶液。取10.00mL溶液于锥形瓶中,用cmol/L碘标准液滴定至终点,消耗标准液的体积为VmL。测定过程中,发生的反应:Na2S2O4+2HCHO+H2O═NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O═NaHSO4+HCHO+4HI,则样品中Na2S2O4·2H2O的纯度为____。
高三化学工业流程困难题查看答案及解析
-
Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
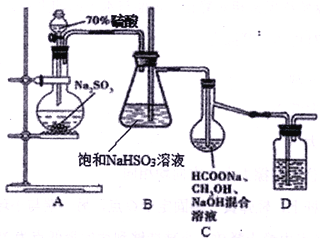
①把甲酸溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如上图所示
(1)A装置中反应的化学方程式为__________________________,为了液体顺利下滴A装置中的分液漏斗改为__________(仪器名称)更合适。
(2)B装置的作用为_____________________________, D中盛放的试剂为 ___________________。
(3)C装置的主要玻璃仪器名称为_________,足量SO2气体通入混合溶液中,生成保险粉的同时生成一种气体,则C中反应的化学方程式为______________________________。
(4)分离C装置中产品Na2S2O4时应选用下列装置__________(填甲、乙、丙、丁,下同),回收甲醇的装置为_______________________。
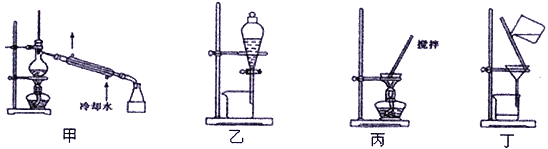
(5)保险粉在空气中容易吸收氧气而发生氧化.其方程式可能为:
①2 Na2S2O4+O2+2H2O=4NaHSO3 或②Na2S2O4+O2+H2O=NaHSO3+NaHSO4
请设计实验证明氧化时有反应②发生:__________________________________________。
高三化学实验题困难题查看答案及解析
-
2016年8月17日,广东警方查获黑窝点非法使用Na2S2O4等浸泡食物来达到保鲜作用,Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
①把甲酸(HCOOH)溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)
装置如图所示:
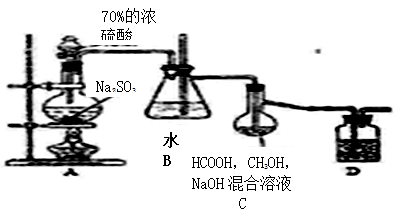
(1)A装置中的分液漏斗改为 (仪器名称)更合适,D中盛放的试剂为 。
(2)B装置的作用为 ;
(3)C装置内发生的化学反应方程式为 。
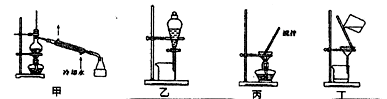
(4)分离C装置中产品时就选用下列装置 (填甲、乙、丙、丁,下同),回收乙醇的装置为 。
(5)Na2S2O4在碱性环境中除去废水中的CrO42-及+4价S的化合物,反应的离子方程式为 。
高三化学实验题困难题查看答案及解析
-
Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
①把甲酸(HCOOH)溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如图所示
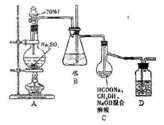
(1)A装置中的分液漏斗改为______(仪器名称)更合适,D中盛放的试剂为_______________。
(2)B装置的作用为___________________________;
(3)C装置的主要仪器名称为________,仪器内发生的化学反应方程式为____________________。
(4)分离C装置中产品时就选用下列装置______(填甲、乙、丙、丁,下同),回收乙醇的装置为_____。
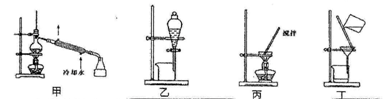
(5)Na2S2O4在碱性环境中除去废水中的CrO42-及+4价S的化合物,反应的离子方程式为_________。
高三化学实验题困难题查看答案及解析