-
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
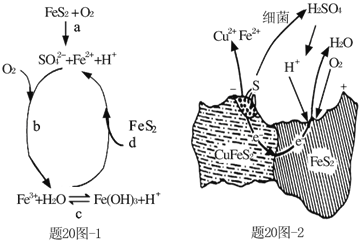
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为___mol。
② d反应的离子方程式为_______________。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
①冶炼过程中,正极周围溶液的pH___(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为___。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g) FeS(s) + H2S(g) FeS(s) + H2S(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g) 1/2Fe(s)+H2S(g) | ΔH2 | K2 |
| FeS(s) + H2(g) Fe(s)+H2S(g) Fe(s)+H2S(g) | ΔH3 | K3 |
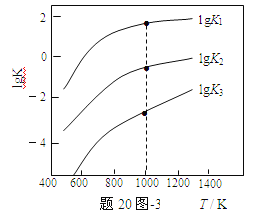
①上述反应中,ΔH1___0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有___(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为___。
-
(14分)黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为 mol。
② d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2

①冶炼过程中,正极周围溶液的pH (选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为 。
 (3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g)  FeS(s) + H2S(g) FeS(s) + H2S(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g) 1/2Fe(s)+H2S(g) | ΔH2 | K2 |
| FeS(s) + H2(g) Fe(s)+H2S(g) Fe(s)+H2S(g) | ΔH3 | K3 |

①上述反应中,ΔH1 0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
-
(18分)自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在。用黄铜矿炼铜的总反应为: 。
。
(1)该反应中_______元素被还原,如果在反应中生成1molCu,转移电子数为____(用NA表示阿伏加德罗常数)。
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式_______(用一个方程式表示)若想提高该过程中SO2的除去速率,可采取的措施为_______(填序号)
A.增大氨水浓度
B.升高反应温度
C.使气体与氨水充分接触
D.通入空气使HSO3-转化为SO42-
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是_______(用离子方程式表示),若水解常数用Kb表示,则该溶液中铵根离子的水解常数Kb约为______________.
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH):n(SO2)=_______时,吸收SO2的成本最低,所得吸收液中各离子浓度大小关系是_______,向吸收液中加入NaOH可得到_______。
-
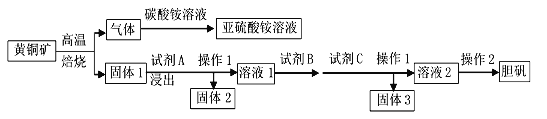
经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:
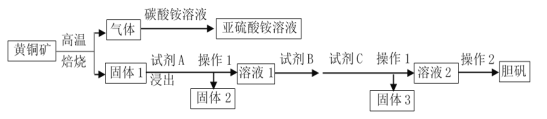
已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______,硫元素在周期表中的位置是______________。写出上述流程中生成亚硫酸铵的离子方程式:_______________________________。
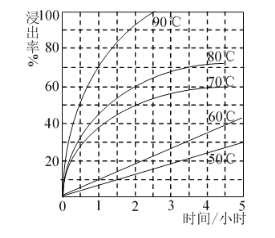
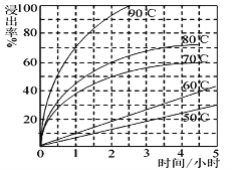
(2)最适合的试剂A是________(写化学式)溶液,固体2的成份为PbSO4和_______。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为_______________。
(3)最适合的试剂B是_______(填序号),最适合的试剂C是______(填序号),固体3的成份为_________________________。
a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和_______,操作2的步骤为________________过滤、洗涤。
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)
-
经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如图:
已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______,硫元素在周期表中的位置是______________。
写出上述流程中生成亚硫酸铵的离子方程式:____________。
(2)最适合的试剂A是________(写化学式)溶液,固体2的成份为PbSO4和_______。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为_______________。
(3)最适合的试剂B是_______(填序号),最适合的试剂C是______(填序号),固体3的成份为_________________________。
a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和_______,操作2的步骤为_______________,_______________,过滤、洗涤。
(5)根据已知图像信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______。
(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)
-
我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
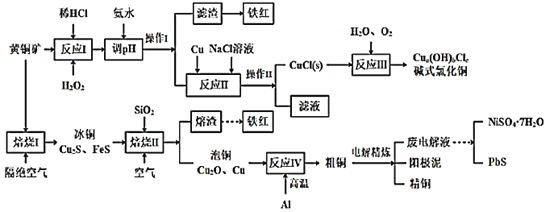
已知:①a、b、c均为整数;②CuCl+2Cl- CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
-
(12分)黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:
稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为_
② 证明炉渣中含有FeO的实验现象为
-
一种以软锰矿(主要成分是MnO2)和黄铜矿(主要成分是FeS2)为原料制取硫酸锰的工艺流程如下:
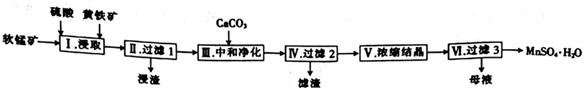
回答下列问题:
(1)浸取前需将软锰矿和黄铁矿进行粉碎,其目的是_____________________________。
(2)浸取过程中生成硫酸铁和硫酸锰的化学方程式为 _______________________________________。
(3)加入CaCO3发生的反应之一为CaCO3+SO42- CaSO4+ CO32-,该反应的平衡常数K=_________[已知Ksp(CaCO3) =2.7×10-9,Ksp(CaSO4) =9.0×10-6,该工艺中有大量硫酸钙沉淀生成,是因为_________________。
CaSO4+ CO32-,该反应的平衡常数K=_________[已知Ksp(CaCO3) =2.7×10-9,Ksp(CaSO4) =9.0×10-6,该工艺中有大量硫酸钙沉淀生成,是因为_________________。
(4)为提高步骤Ⅵ中锰的回收率,可采取的措施是______________________________________。
-
黄铁矿因其浅黄铜色和明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
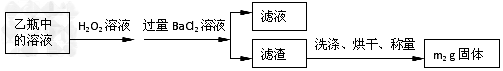
问题讨论:
(1)写出石英管中发生反应的化学方程式为:_________________________________。
(2)I中,干燥管甲内所盛试剂是__________,有同学提出该实验装置存在安全隐患,请用简洁的文字说明:_________________________________________。
(3)该黄铁矿石中硫元素的质量分数为_____________________。
[实验二]:设计以下实验方案测定铁元素的含量
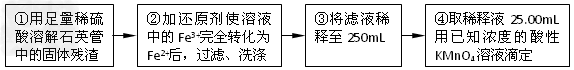
问题讨论:
(4)②中,若选用铁粉作还原剂,会使测量结果______(填“不影响”、“偏高”或“偏低”)。
(5)③中,需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有____________。
(6)④中发生反应的离子方程式为__________________________________________。
-
我国是世界上主要产钼国家之一,我国的钼资源十分丰富,以辉钼矿为主,是具有优势的战略资源。将辉钼矿精矿(主要成分为MoS2,杂质为CaCO3,SiO2,FeS2,CuFeS2,PbS等)除杂提纯可得到粗MoS2,通过精制转化最终可得到纯度更高的MoS2。
MoS2的相关信息:
①具有类似石墨的层状结构,有金属光泽,熔点1185℃,密度4.80g/cm-3,硬度很低,被广泛地应用在润滑领域。
②一般不溶于水、酸、碱和有机溶剂中,但溶于王水和煮沸的浓硫酸。Mo为+4价,在空气中加热至350℃以上开始被氧化,生成钼的氧化物。
有人提出了如下制取高纯MoS2的流程:
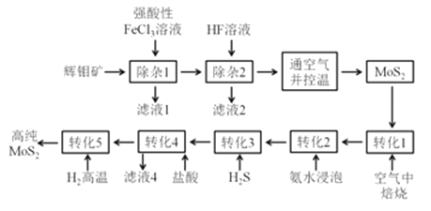
(1) MoS2可用作润滑添加剂的原因是:_____________。
(2)滤液1中存在的阳离子除H+、Ca2+、Pb2+外,还有:____________,写出“除杂1”过程发生的其中1个氧化还原反应的化学方程式:____________。
(3)“通空气并控温”这步操作的目的是:___________。必须控制好温度的原因:___________。
(4)“转化3”得到硫代钼酸铵(NH4)2MoS4。“转化4”中钼的化合价不变,产生气体和沉淀(二元化合物),写出该反应的离子方程式:____。
(5)上述流程中,哪些步骤发生了氧化还原反应:_____。
A.除杂1 B.除杂2 C.转化1 D.转化2 E.转化3 F.转化4 G.转化5
(6)上述流程中,可以循环使用的物质为(写化学式):_______。

(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。



 。
。








