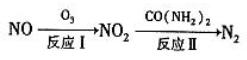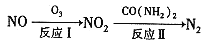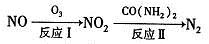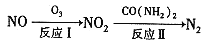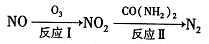-
加强汽车尾气、燃煤企业废气的监测和处理,对于减少雾霾具有重要意义。
(1)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向_____(填“从a到b”或“从b到a”),负极发生的电极反应式为_______________________。

(2)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) N2(g)+O2(g) △H=﹣180.5kJ•mol﹣1
N2(g)+O2(g) △H=﹣180.5kJ•mol﹣1
2H2O(l) = 2H2(g)+O2(g) △H= +571.6kJ•mol﹣1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是_________________________________________________。
(3)上述消除过程中第一步反应起决定作用,某研究小组模拟研究如下:向1L恒容密闭容器中充入a mol NO,其浓度与温度和时间的关系如图所示

①T2下,在0~t1时间内,ν(O2)= mol•L﹣1•min﹣1;反应N2(g)+O2(g) 2NO(g)平衡常数K= (用相关字母表示)。
2NO(g)平衡常数K= (用相关字母表示)。
②该反应进行到M点放出的热量 进行到W点放出的热量 (填”大于” ”小于”或’等于”);M点时再加入一定量NO,平衡后NO的转化率 (填”变大” ”变小”或’不变”)
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号).
a.混合气体的密度
b.混合气体的压强
c.逆反应速率
d.单位时间内,N2和NO的消耗量之比
e.气体的平均相对分子质量
(4)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数Kb=1.8×10-5mol·L-1 H2SO3的电离平衡常数Ka1=1.2×10-2mol·L-1 Ka2=1.3×10-8mol·L-1。在通入废气的过程中
①当恰好形成正盐时,溶液中离子浓度的大小关系为______________________________。
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为________________。
-
利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g)  N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g)  N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
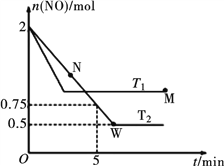
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g)  2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)  LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
-
利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g)  N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g)  N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
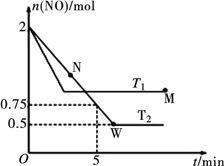
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g)  2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)  LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
-
利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g)  N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g)  N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
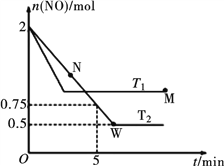
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g)  2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)  LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
-
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为________;
(2)除氮氧化物及CO外,汽车尾气中还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧化物是NO2,碳氢化合物是CxHy,写出两者反应的化学方程式:________,Pt/Al2O3/Ba的作用是________;
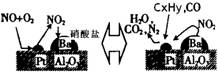
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g)  2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠
2H2(g)+O2(g)  2H2O(g) K2=2×1081 ㈡
2H2O(g) K2=2×1081 ㈡
2CO2 (g)  2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢
 ①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K=________;
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K=________;
②关于以上反应,下列说法正确的是________
A.常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2
B.若升高温度,反应㈢的平衡常数K3将增大
C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大
D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放
③基于环保法规,要求改装汽车尾气处理装置,达到使氮氧化物(NO)、一氧化碳转化为无污染、可排放的气体的目的。改装的方法主要是加入有效催化剂,请你根据以上有关数据分析,在不改变其它条件的情况下,可使用催化剂除污染气体的原因:________。
-
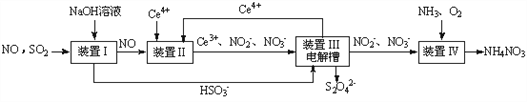
汽车尾气中 CO、NOx 以及燃煤废气中的 SO2 都是大气污染物, 对它们的治理具有重要意义。
(1)氧化还原法消除 NOx 的转化如下: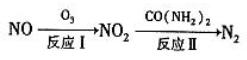
①反应 I 为 NO +O3=NO2+O2,生成标准状况下 11.2 L O2 时,转移电子的物质的量是_______mol。
②反应Ⅱ中, 当 n( NO2): n[CO(NH2)2]=3: 2 时, 氧化产物与还原产物的质量比为_________。
(2)使用“催化转化器”可以减少尾气中的 CO 和 NOx,转化过程中发生反应的化学方程式为 CO+ NOx →N2+CO2(未配平),若 x=1.5,则化学方程式中 CO2 和 N2 的化学计量数比为_________。
(3)吸收 SO2和 NO, 获得 Na2S2O4和 NH4NO3产品的流程图如下(Ce为铈元素)。
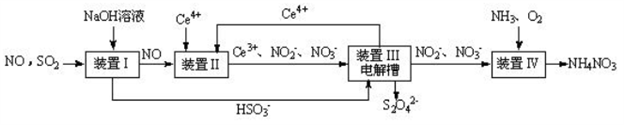
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、 NO2-请写出生成等物质的量的NO3-和NO2-时的离子方程式______________________。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得 Ce4+再生,再生时生成的Ce4+在电解槽的______(填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为_____________。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为 ag.L-1, 要使 1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气_______L(用含 a 代数式表示,结果保留整数)。
-
汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下:
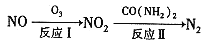
①反应I为NO +O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是__________mol
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置I中发生反应的离子方程式为____________________________________
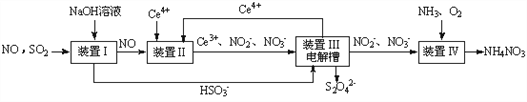
(3)装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式____________________________________
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的_____________(填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为_________________________________
(5)取少量装置Ⅳ所得的产品溶于水,溶液中离子浓度由大到小的顺序为_________________________
-
(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
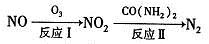
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

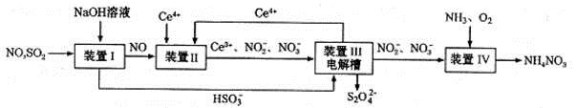
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
-
汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下:
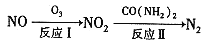
①反应I为NO +O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是__________mol
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置I中发生反应的离子方程式为____________________________________
(3)装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式____________________________________
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的_____________(填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为_________________________________
(5)取少量装置Ⅳ所得的产品溶于水,溶液中离子浓度由大到小的顺序为_________________________
-
(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
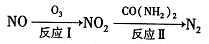
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2 +CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

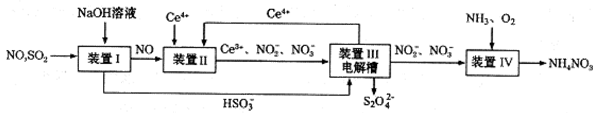
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。

N2(g)+O2(g) △H=﹣180.5kJ•mol﹣1

2NO(g)平衡常数K= (用相关字母表示)。