-
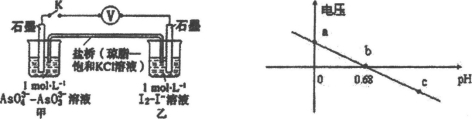
某实验小组研究可逆反应AsO43—+2I—+2H+ AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:
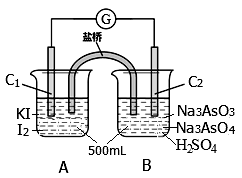
(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下 列判断正确的是 。
列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
A.大于25% B.小于25% c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
-
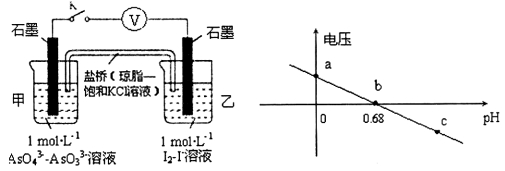
某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
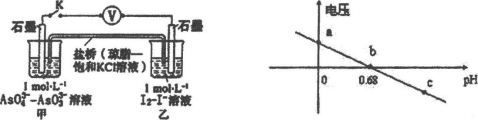
A.c点时,正极的电极反应为ASO43-+2H++2e-=AsO33-+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43-
-
某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
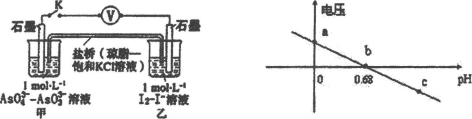
A.c点时,正极的电极反应为ASO43-+2H++2e-=AsO33-+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43-
-
某实验小组依据反应 AsO43-+2H++2I- AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图。下列有关叙述错误的是( )
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图。下列有关叙述错误的是( )
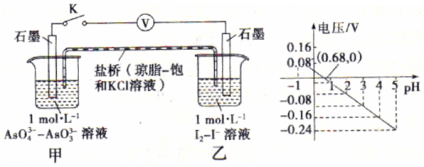
A.调节pH可以改变反应的方向 B.pH=0.68 时,反应处于平衡状态
C.pH=5时,负极电极反应式为2I--2e-═I2 D.pH>0.68时,氧化性I2>AsO43-
-
实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是 ( )
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是 ( )
A.c点时,正极的电极反应为ASO43-+2H++2e-=AsO33-+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43-
-
某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得输出电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得输出电压与pH的关系如图。下列有关叙述错误的是
A.a点时,盐桥中K+向左移动
B.b点时,反应处于化学平衡状态
C.c点时,正极的电极反应为AsO43-+2H++2e-= AsO33-+H2O
D.pH>0.68时,氧化性I2> AsO43-
-
甲、乙两组同学利用如下两反应(K为25℃时的平衡常数)设计成原电池(装置如图)。
① AsO43—+2I-+2H+ AsO33-+I2+H2O K1=14.2
AsO33-+I2+H2O K1=14.2
② 2Fe3++2I- 2Fe2++I2 K2=1.1×108
2Fe2++I2 K2=1.1×108
左池溶液都相同(KI-I2溶液),右池溶液不同:甲组为Na3AsO4和Na3AsO3的混合溶液,乙组为FeCl3和FeCl2的混合溶液。
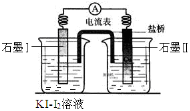
当电流表指针指向零点后再改变右池的条件,改变的条件及电流表指针偏转情况记录如下:
| 操作 | 电流表指针偏转情况 |
| 甲组 | 若滴加浓盐酸 | 偏向左方 |
| 若滴加浓NaOH溶液 | 偏向右方 |
| 乙组 | 若滴加浓FeCl2溶液 | 不偏转 |
| 若滴加浓FeCl3溶液 | 偏向左方 |
则下列叙述错误的是( )
A.同温同浓度时,氧化性:Fe3+>AsO43—
B.与反应②比较,反应①平衡常数小,可逆程度大
C.左池中滴加淀粉溶液变蓝色,再加入足量FeCl2固体,蓝色会褪去
D.甲组在右池加入浓NaOH溶液,此时石墨Ⅱ为负极,AsO33—被氧化
-
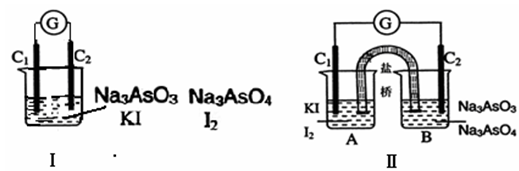
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
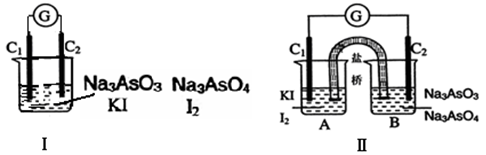
下列叙述中正确的是
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I-
-
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I-
-
已知反应AsO43—+2I-+2H+ AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转。
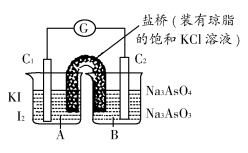
据此,下列判断正确的是 ( )
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作Ⅰ过程中,C2棒上发生的反应为:AsO43—+2H++2e-=AsO33—+H2O
D.操作Ⅱ过程中,C1棒上发生的反应为:2I-=I2+2e-
AsO33—+I2+H2O时,设计了如图所示的原电池:

列判断正确的是 。








