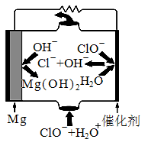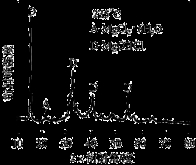-
镁的单质及其化合物用途非常广泛。
(1)镁热还原法可制备铷、钛等金属,已知下列物理常数:
| Mg | Rb | RbCl | MgCl2 |
| 熔点/℃ | 648 | 38.89 | 718 | 714 |
| 沸点/℃ | 1107 | 688 | 1390 | 1412 |
在750℃时可实现用镁还原RbCl制Rb,该反应能够发生的原因是_________________________________(用文字和化学方程式说明)。
(2)无机抗菌剂Mg2ClO(OH)3·H2O(碱式次氯酸镁)可由MgCl2、NaOH及Cl2反应制得,该反应的化学方程式为______________________________________。
(3)CaC2冶镁的原理为CaC2(s)+MgO(s) CaO(s)+Mg(g)+2C(s) △H,反应达到平衡时Mg的产率随温度的变化如图所示。
CaO(s)+Mg(g)+2C(s) △H,反应达到平衡时Mg的产率随温度的变化如图所示。
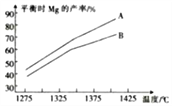
①△H__________(填“>"或“<”,下同)0。
②已知A、B中固体总质量相等,则 :A__________B。
:A__________B。
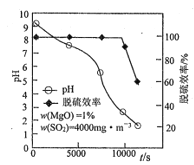
(4)Mg(OH)2浆液可脱除烟气中的SO2,其脱硫效率、pH及时间的关系如图所示。
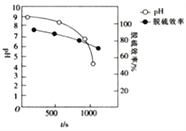
Mg(OH)2浆液脱除SO2的过程中包含的主要反应如下:
Ⅰ.Mg(OH)2+SO2=MgSO3+H2O
Ⅱ.MgSO3+SO2+H2O=Mg(HSO3)2
Ⅲ.Mg(HSO3)2+Mg(OH)2=2MgSO3+2H2O
Ⅳ.2MgSO3+O2=2MgSO4
已知:20℃时,H2SO3的电离平衡常数K1=1.54×10-2、K2=1.02×10-7;25℃时,Ksp[Mg(OH)2]=1.2×10-11,MgSO3,的溶解度为0.646g。
①脱硫过程中使浆液pH减小最显著的反应是__________(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②约900s之后,脱硫效率明显降低,其原因是________________________。
-
镁的单质及其化合物在储氢及大气治理等方面用途非常广泛。
I.工业上可以采用热还原法制备金属镁(沸点1107℃,熔点648.8℃)。 将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先 升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体)。
(1)用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是____________。
(2)碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:_____________。

II.工业上利用纳米MgH2和LiBH4组成的体系储放氢(如题图所示)。
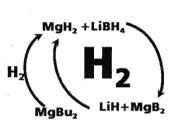
(3)写出放氢过程中发生反应的化学方程式:___________。
III.工业上MgO浆液是高活性的脱硫剂,常用来脱除烟气中的SO2。主要包含的反应有: ① Mg(OH)2+ SO2=MgSO3+H2O ② MgSO3+SO2+H2O= Mg(HSO3)2 ③ Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O ④ 2MgSO3+O2=2MgSO4
脱硫时,MgO的脱硫效率、pH及时间的关系如题图所示。
己知20℃时,H2SO3的K1=l.54×10-2,K2=1.02×10-7,25℃时,Ksp[MgSO3]= 3.86×10-3,Ksp(CaSO3)= 3.1×10-7。
(4)脱硫过程中使浆液pH减小最显著的反应是______________(填①、②、③或④)。
(5)约9000s之后,脱硫效率开始急速降低,其原因是______________。
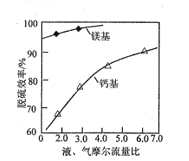
(6)其他条件相同时,镁基和钙基脱硫效率与液、气摩尔流量比如题图所示。镁基脱硫效率总比钙基大,除生成的MgSO4具有良好的水溶性外,还因为______________。
-
已知工业上真空炼铷的反应方程式为:2RbCl + Mg  MgCl2 + 2Rb(g),对于此反应,能够进行正确解释的是 ( )
MgCl2 + 2Rb(g),对于此反应,能够进行正确解释的是 ( )
A.铷比镁金属性强
B.氯化镁比氯化铷难溶
C.高温下,镁离子得电子能力比铷离子弱
D.铷的沸点比镁低,当把铷蒸气抽走时,平衡向右反应方向移动
-
工业上真空炼铷的原理为2RbCl+Mg  MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
-
工业上真空炼铷的原理为2RbCl+Mg  MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
-
(8分)镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1== -74.5kJ/mol
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2== -64.4kJ/mol
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3
则ΔH3== kJ/mol
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;用惰性电极电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110℃﹣200℃的反应为:Mg(AlH4)2===MgH2+2Al+3H2↑,每生成27gAl转移电子的物质的量为 。
-
下列说法不正确的是
A.电解MgCl2浓溶液制取金属Mg B.可用铝热反应原理制取金属Mn
C.钠单质可以从TiCl4中置换出Ti D.可用NH3还原CuO制备单质Cu
-
已知工业上真空炼铷的化学反应方程式为2RbCl+Mg MgCl2+2Rb(g),利用这一反应的原因是( )
MgCl2+2Rb(g),利用这一反应的原因是( )
A.在一定条件下,部分反应都有一定可逆性
B.Mg的金属活动性比Rb强
C.Rb的沸点比Mg低,当把Rb蒸气抽走时,平衡向正反应方向移动
D.MgCl2的热稳定性比RbCl强
-
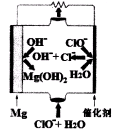
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示:
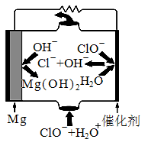
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) MgH2(s) △H1=-74.5kJ·mol-1
MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) 2Mg(s)+Mg2NiH4(s)的△H3= 。
2Mg(s)+Mg2NiH4(s)的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:
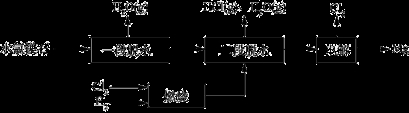
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。

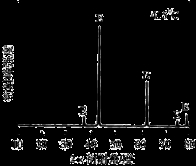
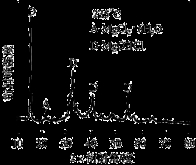
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2 MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
-
(14分)镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1=- 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=- 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3= .
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:
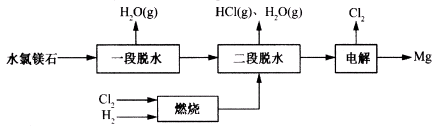
科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
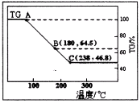
①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式____ ;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是 。
②该工艺中,可以循环使用的物质有___ 。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是 ,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式 。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为____ 。
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 。
CaO(s)+Mg(g)+2C(s) △H,反应达到平衡时Mg的产率随温度的变化如图所示。

:A__________B。