-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮 物质的问题:
物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;
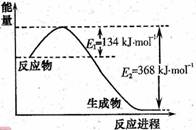
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.v逆(NO2)=v正(NO)
D.容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃ 时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃ 时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡 状态”、“向正反应方向进行”或“向逆反应方向进行”)。
状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列有关含氮物质的问题:
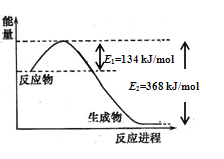
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______________________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是________ 填序号
填序号 。
。
A.容器内混合气体颜色不再变化  容器内的压强保持不变
容器内的压强保持不变
C.v逆(NO2)=v正(NO)  容器内混合气体密度保持不变
容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)⇌2NO(g) ∆H>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应的正反应速率和逆反应速率的关系:v正_____v逆(填“>”、“<”或“=”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2=N2+2H2O。该电池放电时,负极的电极反应式是______________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式____________。
-
(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为________。
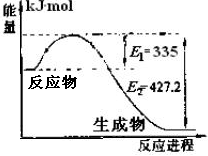
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表:
2NH3(g),其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1________K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是________(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是________(填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) = c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+) >c(OH—)
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为____ _____。
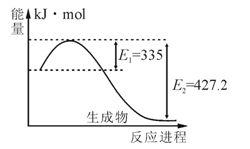
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递 )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2
)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,则在电化学合成氨的过程中,阴极反应式为___ ______。
2NH3,则在电化学合成氨的过程中,阴极反应式为___ ______。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3(g)
2NH3(g)
△H<0,其化学平衡常数K与t的关系如下表:
| t / K | 298 | 398 | 498 | …… |
| K / (mol·L-1)-2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①写出Km的表达式________,判断K1的相对大小,K1_______4.1×106 (填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B. v(N2)(正) = 3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
E. 浓度积Q=K时
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是________。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为( )
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
B.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
D.C(NH4+)>C(Cl-)>C(H+)>C(OH-)
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________.
(2)在________中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/ | 4.1×106 | K1 | K2 | … |
请完成下列问题:
①写出该反应的平衡常数表达式:K=________
②试比较K1、K2的大小,K1________K2(填写“>”“=”或“<”)
③下列各项能作为判断该反应达到化学平衡状态的依据的是________(填序号字母,多选倒扣分!).
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
④400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数的值为________.
N2(g)+3H2(g)的化学平衡常数的值为________.
当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的υ(N2)(正)________ υ(N2)(逆)(填写“>”、“=”或“<”).
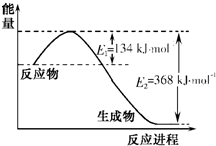
-
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)  2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1____K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是____一(填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为________。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __v(N2)逆(填写“>”、“=”或“<”=)
N2(g)+3H2(g)的化学平衡常数的值为________。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __v(N2)逆(填写“>”、“=”或“<”=)
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式________,该反应的熵变⊿S________0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
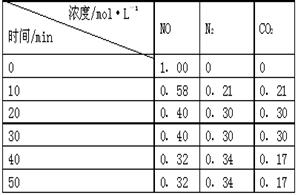
①10min~20min以V(CO2) 表示的反应速率为 ________。
②该反应的平衡常数的表达式为:K=________,根据表中数据,计算T1℃时该反应的平衡常数为________ ________(保留两位小数)。
③下列各项能作为判断该反应达到平衡的是________(填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”) 。
-
(14分)I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
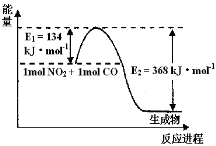
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)=________。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度________(填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”、“向右”或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”、“向右”或“不”)。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
| T/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | ⑤.00 | 3.50 | 2.42 |
则500s内N2O5的分解速度v(N2O5)=________;降温至T2,反应进行1000s时测得c(NO2)=4.98mol·L-1,则反应N2O5(g) NO2(g)+O2(g)的△H________0。(填“>”、“=”、“<”)。
NO2(g)+O2(g)的△H________0。(填“>”、“=”、“<”)。
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:
4NH3+3O2 2N2+6H2O。你认为电解质溶液应显________(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式________。
-
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
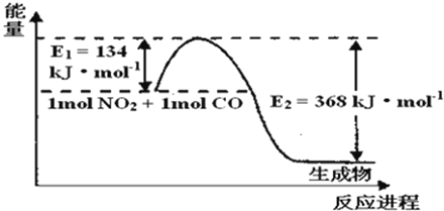
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”、“向右”或“不”)。
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
NO2(g)+O2(g)的△H________0。(填“>”、“=”、“<”)。








