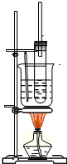-
某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
| 步骤和现象 | 现象 |
| Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y | 
|
| Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
| Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
| Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为__________________________。
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3¯,还含有的离子有_________________。
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为_______________。沉淀转化的主要原因是______________。
(4)已知:Ag+ + 2NH3· H2O  Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
(5)结合上述信息分析,下列预测不正确的是 。
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解
-
某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 沉淀逐渐溶解
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为_______________;
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3﹣,还含有的离子有_______________;
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为____________.沉淀转化的主要原因是_____________;
(4)已知:Ag++2NH3•H2O===Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因______________;
-
某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 沉淀逐渐溶解
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为 .
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3﹣,还含有的离子有 .
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为 .沉淀转化的主要原因是 .
(4)已知:Ag++2NH3•H2O===Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因 .
-
室温时,下列关于各溶液的叙述中正确的是
A.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B.实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的时间间隔相同
C.向0.1 mol·L-1醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体产生
D.0.10 mol·L-1 CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
-
下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向浓度均为0.1mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向苯酚浊液中加入Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>HCO3- |
| C | 用饱和碳酸钠溶液浸泡锅炉沉积物后,再加入稀盐酸 | 有气泡产生 | 可除去锅炉沉积物中的CaSO4 |
| D | 淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴 | 无银镜出现 | 淀粉没有水解 |
A.A B.B C.C D.D
-
下列实验现象及结论正确的是
A. 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP (AgCl)> KSP (AgI)
B. 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者
C. Na2CO3溶液滴入足量硼酸溶液中,无气泡生成,说明Ka: H2CO3>H3BO3
D. 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者等于后者
-
下列依据相关实验得出的结论正确的是
A.向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI)
B.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
C.用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液
D.用铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液
-
某研究小组以银盐为实验对象,研究难溶盐时进行了如下实验:
①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色;
④向AgI中滴加0.1 mol·L-l NaCl溶液,无明显现象。
已知:25℃时,AgCl和AgI的溶解度分别是1.5×10-4 g和3×10-7 g
请回答:
(1)沉淀c是__________。
(2)步骤②中的现象说明滤液b中含有的微粒是_________。
(3)步骤③中反应的离子方程式是__________。
(4)根据实验,可以得出的结论是___________。
-
(1)探究一溴环己烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙两位同学分别设计如下两个实验方案:
甲:向反应混合物中滴入稀HNO3中和NaOH,后滴入AgNO3溶液,若有浅黄色沉淀,则可以证明发生了消去反应。
乙:向反应混合物中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。请评价上述两个方案是否合理,并说明理由。
甲:_________,______________________________________________________。
乙:_________,______________________________________________________。
(2)如图所示为实验室制取少量硝基苯的装置.根据题意完成下列填空:
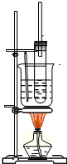
①写出制取硝基苯的化学方程式_______________________。
②长玻璃导管的作用是_______________________。
③硝基苯有毒,如果少量的液体溅在皮肤上,应用 擦洗.
A.苯 B.酒精 C.硫酸 D.水.
(3)某实验小组用下列装置进行乙醇催化氧化的实验.
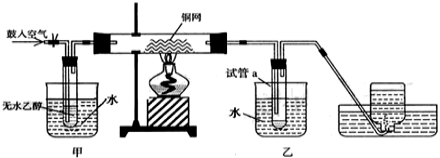
甲和乙两个水浴作用不相同.甲的作用是 ;
乙的作用是______________。
-
为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三名同学分别设计如下三个实验方案。
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三名同学分别设计如下三个实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。其中正确的是( )
A.甲 B.乙 C.丙 D.上述实验方案都不正确
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。