-
过氧化钙常用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂。在食品、牙粉、化妆品等制造中广泛使用。查阅资料:过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
(Ⅰ)CaO2的制备原理:CaCl2+H2O2 +2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl 实验步骤、反应装置如图所示,请回答下列问题:
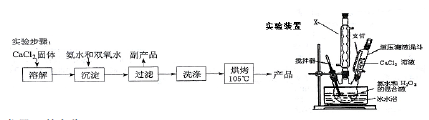
(1)仪器X的名称 。
(2)加入氨水的作用是 。
(3)该合成反应生成沉淀的过程中,关键是控制温度,其合理的措施是 。
A.冰水浴 B.不断搅拌
C.逐滴滴加CaCl2溶液 D.直接加CaCl2固体,而不用其溶液滴加
(4)① 过滤后洗涤沉淀的试剂最好用 。
A.热水 B.冷水 C.乙醇 D.乙醚
② 如何判断沉淀已经洗涤干净 。
(Ⅱ)产品稳定性分析:取I中所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000 mol·L-1酸性高锰酸钾溶液滴定生成的H2O2 (KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表
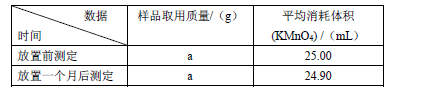
已知:a.H2O2 不稳定,加热,加入某些金属离子或加碱均有利于其分解。
b.产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%
(5)用KMnO4滴定,达到滴定终点时的现象是 。
(6)该产品的“产品稳定性”= 。
-
过氧化钙是重要的化工原料,易溶于酸、难溶于水、乙醇等溶剂,温度在350℃以上容易分解。其主要用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。农业上用作种子及谷物的无毒性消毒剂及鱼池的增氧剂。
(1)过氧化钙工业上常用以下合成路线进行合成。
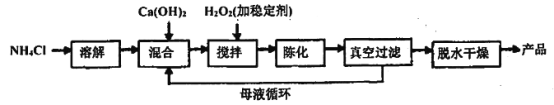
已知:氯化铵的作用是提高Ca2+的浓度。
①反应温度需要控制在常温下产率最高,温度过高或过低都会使产率降低的原因是___________________,母液的主要溶质是__________。
②整个过程的总化学方程式为_____________________________________________。
(2)实验室也可利用反应Ca(s)+O2(g) CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
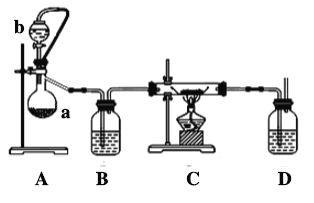
请回答下列问题:
①仪器a的名称为________,仪器a上方橡皮管的作用是______________,D装置中的试剂为________。
②根据完整的实验装置进行实验,实验步骤如下:检验装置的气密性后,装入药品;打开分液漏斗活塞,通入一段时间气体,加热药品;待反应结束后,操作顺序为____________(填序号);拆除装置,取出产物。
a 停止通入氧气并关闭分液漏斗的活塞 b 熄灭酒精灯 c 反应管冷却至室温
(3)利用如图装置测定反应2CaO2 2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是___________,若B装置直接读数确定25℃、1个标准大气压下气体的体积,则测量结果_______(填“偏大”、“偏小”或“无影响”)。
2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是___________,若B装置直接读数确定25℃、1个标准大气压下气体的体积,则测量结果_______(填“偏大”、“偏小”或“无影响”)。

-
过氧化钙(CaO2)常用作食品、牙粉、化妆品的添加剂,也可用作种子的消毒剂。已知从溶液中制备的过氧化钙带有8个结晶水,在100℃时会脱水生成米黄色的无水过氧化钙,而无水过氧化钙在350℃时会迅速分解生成CaO和O2。回答下列问题:
①CaO2中含有的化学键类型是________________。
(2)实验室用纯净的CaCO3与H2O2制取过氧化钙的实验步骤如下:
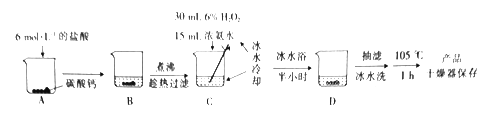
①烧杯A中发生反应的离子方程式为_____________________ 。
②过滤时用到的玻璃仪器除烧杯外,还有______________________。
③用冰水冷却烧杯C的目的是___________________。
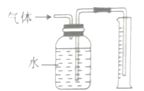
(3)为测定产品中CaO2的质量分数,取m g样品,在温度高于350℃时使之充分分解,并将产生的气体(恢复至标准状况)通过下图所示装置,收集到水的体积为V mL,则产品CaO2的质量分数为__________(列出表达式即可)。
-
卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
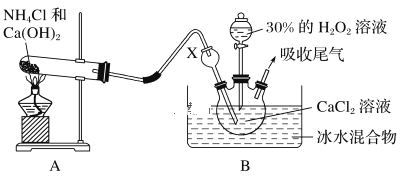
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
-
过氧化钙是一种白色固体,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。
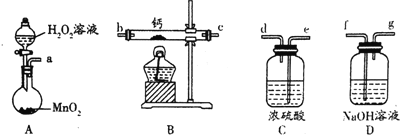
①请选择必要的装置(装置可重复使用),按气流方向连接顺序为__________________。(填仪器接口的字母编号)
②连接好装置进行实验,步骤如下:
I.检查装置气密性后,装入药品;
II._____________________;
III.点燃B处酒精灯加热药品;反应结束后,_______________________________;
Ⅳ.拆除装置,取出产物。
(2)已知化学反应Ca2++H2O2+2NH3+8H2O= CaO2·8H2O↓+2NH4+。在碱性环境中制取CaO2·8H2O的装置如下图:
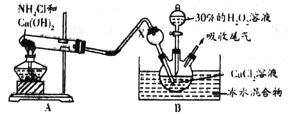
①装置B中仪器X的作用是__________________________________;反应在冰水浴中进行的原因是__________________________________________________________。
②反应结束后,经________、__________、低温烘干获得CaO2·8H2O。
-
(14分)双氧水(过氧化氯)被称作“最清洁”的化学品,在纺织业和造纸业主要用作漂白剂,在化工合成中用作氧化剂和环氧化剂,在食品和医药工业中用作消毒剂、杀菌剂。目前,世界上过氧化氢的生产方法主要有电解法、葸醌法等。
I、电解法中成本最低的是过硫酸铵法
电解所用电槽以铂为阳极,以铅或石墨为阴极;NH4HSO4水溶液经阴极室,再作为阳极液从阳极室流出,得(NH4)2S2O8溶液,电解总反应式: 溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
(1)写出过氧化氢的电子式________。
(2)写出水解器中(NH4)2S2O8溶液的水解方程式________。
(3)铂价格昂贵,试分析电槽阳极用铂不用铅的原因________。
(4)试分析水解器中使用减压水解、蒸发的原因。
Ⅱ、葸醌法是国内外大规模生产过氧化氢普遍采用的方法,生产简易流程图如下所示:
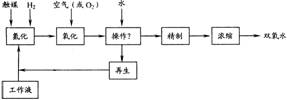
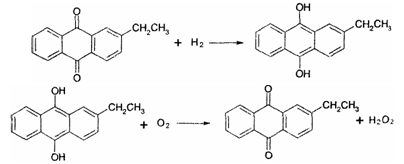
其中,触媒为催化剂,工作液为乙基葸醌与有机溶剂的混合液,主要反应方程式为:
(1)写出流程图中加“?”的操作________。
(2)写出流程图中再生使用物质的名称________。
(3)根据双氧水生产的特点,工业液中有机溶剂的选择很重要。理想的有机溶剂应满足以下要求:①对乙基葸醌和氢乙基葸醌具有良好的溶解能力:②粘度低,沸点高,难挥发,着火点高;③低毒性。请分析再写出两点要求:④________;⑤________。
-
(11分)过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验。
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是________;
(2) 资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是 ________。

Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
| 实验编号 | T/℃ | H2O2初始浓度/ mol·L-1 | FeCl3初始浓度/ mol·L-1 |
| Ⅰ | 20 | 1.0 | |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | | 0.1 |
①实验Ⅰ、Ⅱ研究温度对分解速率的影响,则实验Ⅰ中FeCl3初始浓度应为________mol·L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为________mol·L-1。
②三组实验中分解速率最快的是________(填编号)。
Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+ =2Mn2++8H2O+ 5O2
(4)滴定到达终点的现象是__________________________________________________。
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为________mol·L-1。
(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________ (“偏高”或“偏低”或“不变”)。
-
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是______;
(2)资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是______ H2O2
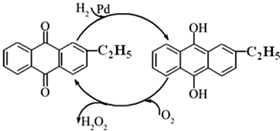
-
过氧乙酸是一种弱酸性氧化剂,广泛用作漂白剂和高效杀菌消毒剂等。
Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h。
反应原理为:H2O2+CH3COOH
 (过氧乙酸)+H2O
(过氧乙酸)+H2O
Ⅱ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用。取上述稀释后过氧乙酸试样5.00mL,用0.0100 mol·L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL,加入0.5%淀粉溶液3滴,摇匀,并用0.0500 mol·L-1Na2S2O3标准溶液滴定到蓝色刚好褪去(离子反应方程式为:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL。
(1)制备过氧乙酸时,温度不宜过高,其原因可能是________。
(2)稀释样品时,除用到容量瓶及烧杯外,还用到的玻璃仪器有________、________。
(3)过氧乙酸溶液与KI反应的离子方程式为________。
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程)。________。
-
过碳酸钠是过氧化氢与碳酸钠通过反应而制得,主要用作漂白剂和氧化剂,以及去污剂、清洗剂、杀菌剂一种制备工艺如下。

(1)工业Na2CO3中含有Fe3+、Cu2+、Mn2+等杂质,使用前必须精制,原因是_______。
(2)一种精制流程为:

流程中通入过量CO2的目的是________,300℃时发生反应的化学方程式________。
(3)反应器温度维持在15℃左右,加入反应物,反应半小时即可得到大量晶体,如果反应温度过高,可能发生的副反应是________,如果温度过低造成的影响是_________。
(4)MgSO4和Na2SiO3的混合物是常见的稳定剂,关于稳定剂的说法中正确的是________。
A.稳定剂反应生成的沉淀将过碳酸钠包住,在其外表面形成涂层,使过碳酸钠与外界隔离
B.稳定剂可以结合使过氧化氢分解的有害离子
C.稳定剂宜多不宜少,通过改变溶液的酸碱性,使过碳酸钠更稳定
(5)过碳酸钠应如何保存_______________。















