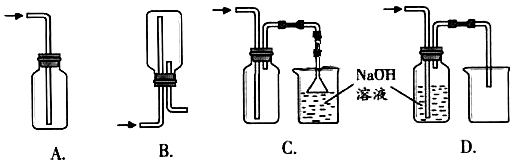-
氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2 过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3 过滤
过滤 过量HCl
过量HCl
B.过量的NaOH 过量Na2CO3
过量Na2CO3 过量BaCl2
过量BaCl2 过滤
过滤 过量HCl
过量HCl
C.过量的BaCl2 过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH 过滤
过滤 过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式 。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。

阴极反应式为 ;反应类型 (填氧化或还原反应),
总电极反应式为 。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
① 下列收集Cl2的装置正确的是_______________ ;
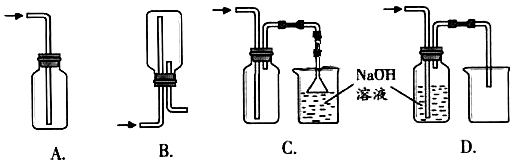
②检验是否有氯气生成可采用的方法是 ;
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式 。
-
下列说法正确的是( )
A.调味剂和着色剂是食品添加剂,添加量越多越好
B.钾是人体必需的微量元素,食盐的主要成分是KCl
C.维牛素C在人体内有重要功能,维生素C不溶于水
D.蔬菜、水果富含膳食纤维,适量摄入有利人体健康
-
营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①人体需要的营养素主要有糖类、 、蛋白质、无机盐、维生素和水。在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是 。
②下列物质中,具有解热镇痛疗效的是 (填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③有些药片常用淀粉作为黏合剂,淀粉进入人体后在人体内酶的催化作用下逐步水解,最终转化为 (填物质的名称)。维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和 试剂共同完成。
-
下列说法正确的是
A. 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B. 氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C. 在苯酚和乙醇性质比较实验中,将等物质的量的乙醇和苯酚置于试管中,再投入金属钠,从而可以比较出羟基氢的活泼性
D. 抽滤完毕,直接用玻璃棒刮下布氏漏斗中滤纸上的固体
-
.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
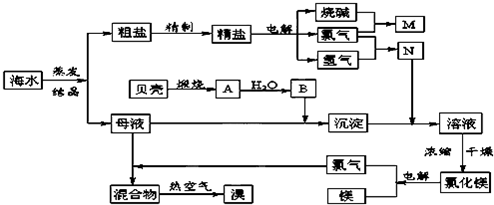
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)________.
(2)Mg(OH)2中加入盐酸后,要获得MgCl2•6H2O晶体,需要进行的实验操作依次________.
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是________.
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的电极反应方程式:________.
(5)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)________.
(6)利用MgCl2•6H2O可制得无水氯化镁,应采取的措施是________.
(7)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:________.
-
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
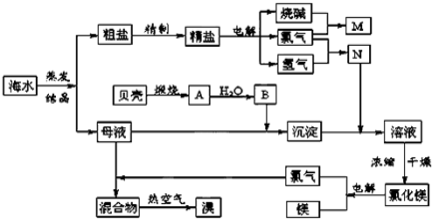
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液
则加入试剂的顺序是(填编号) 。
(2)Mg(OH) 2中加入盐酸后,要获得MgCl 2•6H 2O晶体,需要进行的实验操作依次 。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 .
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的离子方程式:
(5) 利用MgCl 2•6H 2O可制得无水氯化镁,应采取的措施是
(6) 用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
-
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
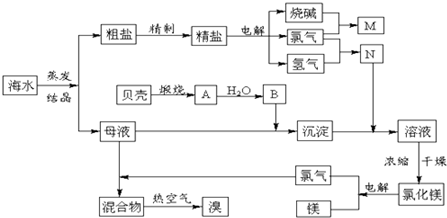
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)______.
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是______.
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:______ Cl2↑+H2↑+2OH-
-
下列说法不正确的是( )
A.醋酸和硬脂酸互为同系物,C2H6和C9H20也互为同系物
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
D.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解
-
下列说法正确的是
A. 调味剂和着色剂是食品添加剂,添加量越多越好
B. 蔬菜、水果富含膳食纤维,适量摄入有利人体健康
C. 维牛素C在人体内有重要功能,维生素c不溶于水
D. 钾是人体必需的微量元素,食盐的主要成分是KCl
-
下列说法正确的是
A. 调味剂和着色剂是食品添加剂,添加量越多越好
B. 蔬菜、水果富含膳食纤维,适量摄入有利人体健康
C. 维生素c在人体内有重要功能,维生素c不溶于水
D. 钾是人体必需的微量元素,食盐的主要成分是KCl

过量NaOH
过量Na2CO3
过滤
过量HCl
过量Na2CO3
过量BaCl2
过滤
过量HCl
过量Na2CO3
过量NaOH
过滤
过量HCl
过量 BaCl2
过量Na2CO3
过量HCl
过滤