-
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂。
(1)若假设1成立,则实验现象是_______________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________简述你的理由(不需写出反应的方程式)____________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是__________,写出发生反应的离子方程式______、__________、______________。
探究延伸:
(4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为__________。
高一化学实验题困难题查看答案及解析
-
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是______.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______,简述你的理由(不需写出反应的方程式 )______
(3)若固体粉末完全溶解,向所得溶液中滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是______,写出实验过程中发生的氧化还原反应的离子方程式______
探究延伸:若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______.
(5)某铝土矿样品经测定是由Al2O3、Fe2O3、FeO、SiO2等氧化物组成,取样品适量放入烧杯中,加入稀硫酸将其溶解,过滤,取滤液少量于试管中,若证明滤液中含有+2价的铁,选用的试剂和现象为______.高一化学解答题中等难度题查看答案及解析
-
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
⑴若假设1成立,则实验现象是。
⑵若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________,简述你的理由(不需写出反应的方程式 )________
⑶若固体粉末完全溶解, 向所得溶液中滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是________,写出实验过程中发生的氧化还原反应的离子方程式________
探究延伸:若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
⑷实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为________。
⑸某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,取样品适量放入烧杯中,加入稀硫酸将其溶解,过滤,取滤液少量于试管中,若证明滤液中含有+2价的铁,选用的试剂和现象为.
高一化学实验题中等难度题查看答案及解析
-
Fe2O3和Cu2O都是红色粉末,常用作颜料.实验小组通过实验来探究某一红色粉末中Fe2O3和Cu2O的含量(不含其他物质)。
已知:Cu2O+H2SO4=Cu+Cu SO4+H2O
探究过程如下:
取少量该粉末放入 足量稀硫酸中,粉末完全溶解。
(1)①若滴加KSCN试剂后溶液不变为红色,则Fe2O3和Cu2O的物质的量之比为________。
②实验小组发现可通过对反应后溶液的称量来获得绿矾晶体(FeSO4·7H2O),设计了简单的流程来完成绿矾的制备:
混合液
过滤
一系列操作
绿矾晶体(FeSO4·7H2O)
试剂a为_____________(填化学式),“一系列操作”为__________、__________、过滤、洗涤、干燥。
(2)测定Cu2O的质量分数:另取一种由Fe2O3和Cu2O组成的固体混合物9.28g,将其放在空气中充分加热(只发生Cu2O→CuO的反应),待质量不再变化时,测得质量为9.60g,则固体混合物中Cu2O的质量分数为_________________(保留三位有效数字)
高一化学实验题中等难度题查看答案及解析
-
(20分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?___________。简述你的理由_____________________________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。
写出实验过程中发生反应的离子方程式_____________________、___________________________、________________________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________________。
高一化学实验题中等难度题查看答案及解析
-
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
高一化学实验题困难题查看答案及解析
-
Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______.
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是______.
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______.简述你的理由______.
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设______成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______.
高一化学实验题中等难度题查看答案及解析
-
Fe2O3和Cu2O是红色粉末,常作颜料。某校化学实验小组通过实验来探究红色粉末的成分是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是____;若假设2成立,发生反应的离子方程式为______。
(2)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,设计实验计算二者的物质的量:取一定量的该固体粉末溶于500 mL未知浓度的稀硫酸溶液中,固体全部溶解,向反应后的溶液中加入Fe粉,溶液中部分离子的物质的量随Fe粉加入,变化如图所示,则Fe2O3和Cu2O的物质的量分别为____、 _______。
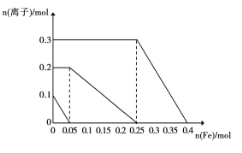
(3)硫酸溶液的物质的量浓度是____。
高一化学实验题中等难度题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴越小组对其组成进行探究。
已知Cu2O在酸性溶液中会发生歧化反应:Cu2O+2H+=Cu+Cu2++H2O。
方案一:
(1)学生甲取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出样品中一定含有_______,写出产生上述气体的化学方程式_____________。
(2)进一步探究样品中另一种成分。实验操作步骤为:取少量上述反应后溶液,加入______(填化学式)溶液,观察现象。
方案二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的____。
A.若固体全部溶解,说明样品一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
方案三:
学生丙利用下图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
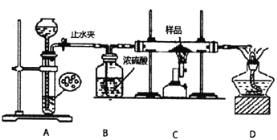
(4)装置A是氢气的发生装置,可以使用的药品是______(填选项)。
A.氢氧化钠溶液和铝片 B.稀硝酸和铁片 C.稀硫酸利锌片 D.浓硫酸和镁片
(5)下列实验步骤的先后顺序是_____(填序号)。
①打开止水夹 ②关闭止水夹 ③点燃C处的酒精喷灯
④熄灭C处的酒精喷灯 ⑤收集氢气并验纯
(6)假设样品全部参加反应生成相应金属单质,若实验前样品的质量为15.2g,实验后称得装置C中固体的质最为12.0g。则样品的组成是(若有多种成分,则须求出各成分的质量)_____。
高一化学实验题中等难度题查看答案及解析
-
下列描述中,不正确的是( )
A. FeSO4 可用于防止食品氧化变质,延长食品的保质期
B. Fe2O3为红棕色粉末,生活中常用作颜料
C. 向Fe2(SO4)3 溶液中加入足量的铁粉,充分反应后,滴加KSCN溶液,溶液马上变成血红色
D. 铁和水蒸气反应,生成紫黑色的Fe3O4
高一化学单选题中等难度题查看答案及解析