-
(16分)下表是元素周期表的一部分,回答下列有关问题:
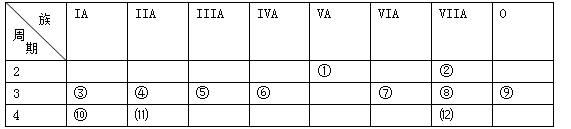
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)在①-⑿元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强
高一化学填空题极难题查看答案及解析
-
下表是元素周期表的一部分。
根据①~⑿元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
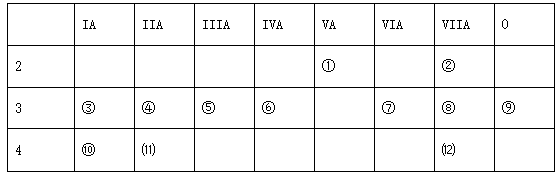
(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)画出原子结构示意图:⑾ 。
(5)用电子式表示⑦和⑩形成化合物的过程: 。
(6)⑦和⑧分别形成的气态氢化物的化学式是 、 。其中相对不稳定的是 。
(7)在③与④中,化学性质较活泼的是 ,(填元素符号)
在⑧与⑿中,化学性质较活泼的是 ,(填元素符号)如何证明(用离子方程式表示):
。
高一化学填空题简单题查看答案及解析
-
下表是元素周期表的一部分,回答下列有关问题:
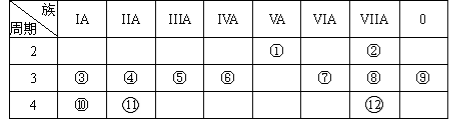
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑤ ,⑧ 。
(3)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。(均填元素符号)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(5)在③与④中,化学性质较活泼的是 (填元素符号),怎样用化学实验证明:
答: (该空2分,其余每空1分)
高一化学填空题中等难度题查看答案及解析
-
下表是元素周期表的一部分。
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
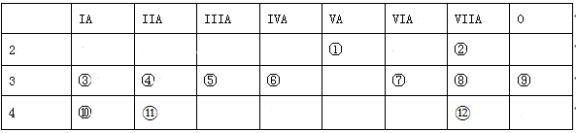
(1)写出下列元素符号:① ,⑥ 。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,呈两性的氢氧化物是 。(用化学式填写)
(3)在这些元素中单质的氧化性最强的是 ,还原性最强的是 。化学性质最不活泼的元素是 。(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: 。
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是 。
高一化学填空题中等难度题查看答案及解析
-
(12分)下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
4
⑩
(1)在①~⑩元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。
(2)在①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是________,呈两性的是________。写出在水溶液中三者之间相互反应的离子方程式:,
________,
________________________。
高一化学填空题简单题查看答案及解析
-
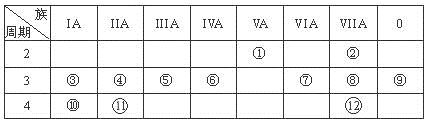
(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~⑫元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 ________________________________________________ (用元素符号表示),下列表述中能证明这一事实的是 ________________ ________________ ________ 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是________________ ________________________(用元素符号表示),跟它同周期的ⅦA元素是________________________________ (用元素符号表示)
高一化学填空题中等难度题查看答案及解析
-
(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~⑫元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
高一化学填空题中等难度题查看答案及解析
-
下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
(1)在①~⑩元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
族
周期ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ① ② ③ 3 ④ ⑤ ⑥ ⑦ ⑧ ⑨ 4 ⑩
(2)在①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是______,呈两性的是______.写出在水溶液中三者之间相互反应的离子方程式:______,______,______.高一化学解答题中等难度题查看答案及解析
-
表是元素周期表的一部分,请用元素符号、离子符号或相关化学式回答有关问题:
主族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
⑩
(1)表中能形成两性氢氧化物的元素在周期表中的位置是________;
(2)写出②的气态氢化物的结构式________;
(3)元素④⑤⑥⑦离子半径由大到小的顺序________;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是________;④、⑤、⑨三种元素的最高价氧化物的水化物中碱性最强的是________;
(5)⑦和⑩氧化性较强的是________用一个置换反应证实这一结论(写化学方程式)___________________________。
(6)④⑤两元素相比较,金属性较强的是________,可以验证该结论的实验是________;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
高一化学推断题中等难度题查看答案及解析
-
(12分)下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
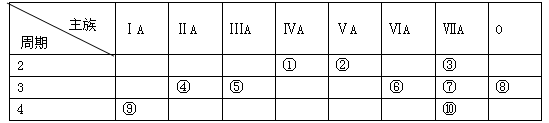
(1)表中化学性质最不活泼的元素是 ,最活泼的金属元素是 ,最活泼的非金属元素是 。
(2)表中能形成两性氧化物的元素是 ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)③⑥⑦三种元素原子半径由大到小的顺序是 。
(4)用电子式表示由元素⑨⑦形成化合物的过程: 。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
实验步骤
实验现象与结论
高一化学填空题中等难度题查看答案及解析