-
(14分)已知NO2和N2O4之间发生可逆反应: 2NO2 (g) (红棕色) N2O4(g) (无色)
(1)在烧瓶A和B中盛有相同浓度的NO2和N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。
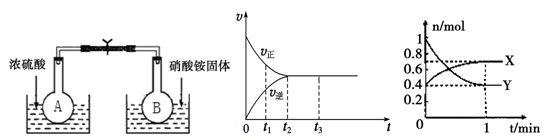
分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中 。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生化学平衡的移动。下列条件的改变,能使该反应化学平衡正向移动的是 。
a.及时分离出NO2气体 b.适当降低温度
c.增大压强 d.选择高效催化剂
(2)下图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是 。
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某容积2L的密闭容器中充入一定量的NO2和N2O4的混合气体,在一定温度压强下,两者物质的量随时间变化如图所示。
①表示NO2变化的曲线是 (填“X”或“Y”)。
②在0到1 min内用Y的浓度变化表示的该反应的反应速率是 mol•L-1•min-1
③计算该反应平衡时化学反应平衡常数K= 。
-
将0.1mol N2O4置于1L密闭烧瓶中,然后将烧瓶放入100℃的恒温槽,烧瓶内的气体逐渐变为红棕色:N2O4(g)(无色)═2NO2(g)(红棕色)下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
A.烧瓶内气体的颜色不变,不再加深
B.N2O4的消耗速率与NO2的生成速率之比为1:2
C.NO2的生成速率与NO2的消耗速率相等
D.NO2的物质的量浓度不变
-
已知N2O4(无色) 2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )
2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )
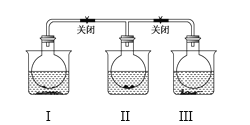
A. CaO溶于水时吸收热量 B. 该反应的ΔH>0
C. NH4Cl溶于水时放出热量 D. 烧瓶(III)中气体的压强增大
-
已知反应:2NO2(红棕色) N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(NO2) | 0.40 | a | 0.26 | c | d | e |
| n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20至40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)

(4)能说明反应2NO2(红棕色) N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变 B. 恒容条件下,气体的密度不变
C. 2v正(NO2)=v逆(N2O4) D. 混合气体的平均摩尔质量不变
-
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
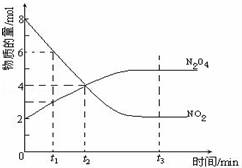
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol•L﹣1•s﹣1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率.
-
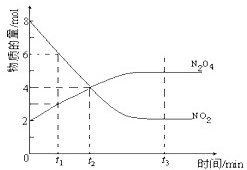
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:________
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:________mol•L-1•s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:________
(4)t1时,正反应速率________(填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向________ 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色________(填“变深”、“变浅”或“不变”)
-
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
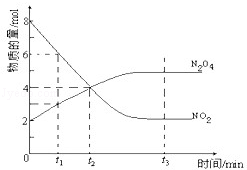
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol•L﹣1•s﹣1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)
-
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:________
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: ________mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 ________ (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 ________ ________
(填“变深”、“变浅”或“不变”)
-
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
-
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大







