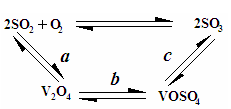-
硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2+11O2  2Fe2O3+8SO2;该反应中氧化剂和氧化产物的物质的量之比为______;标准状态下得到4.48升SO2时,一共转移了______mole-.
2Fe2O3+8SO2;该反应中氧化剂和氧化产物的物质的量之比为______;标准状态下得到4.48升SO2时,一共转移了______mole-.
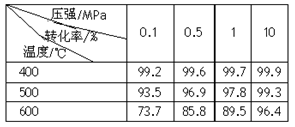
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:
压强/MPa
转化率/%
温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
根据上表回答,SO2转化到SO3的最佳反应条件是______.
A.400-500℃0.1MPa B.400℃10MPa
C.500℃10MPa D.400-500℃1MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:______.若在该条件下将2mol SO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为______ (用含Q1、Q2代数式表示).
(4)市售浓硫酸的密度是1.84g/cm3、质量分数为98%,若用H2SO4•XH2O来表示这种浓硫酸,则X为______.
-
(14分) 硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
该反应中氧化剂和氧化产物之比为 ________;标准状态下得到4.48升SO2 时,一共转移了 ________mol e- 。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是________。(每空2分)
A.400-500℃ 0.1 MPa B.400℃ 10 MPa
C.500℃ 10 MPa D.400-500℃ 1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:________。若在该条件下将2 mol SO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为________ (用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为________ 。(每空2分)
-
(12分)【化学——化学与技术】
工业上以黄铁矿为原料,采用接触法生产硫酸。请回答下列问题:
(1)煅烧黄铁矿的设备名称是__________,进料前必须将黄铁矿粉碎,目的是________。所得炉渣的用途有__________________________(填一种用途)。
(2)进入接触室前的气体必须经过净化处理,目的是防止________________________________。
(3)生产过程中,吸收三氧化硫常用的物质是_____________________________。
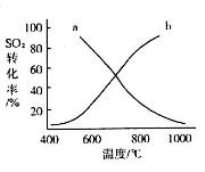
(4)温度变化与二氧化硫转化率的变化关系可用下图中的曲线______(填“a”或“b”)表示。
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体。反应的化学方程式为:
________________________________、_________________________________。
-
(13分)氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
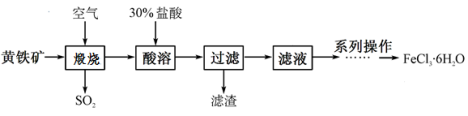
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
-
[化学——选修2:化学与技术]
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为_________________;该反应在___________________(填设备名称)中进行。
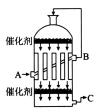
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的______(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有_______(填设备名称)中用______吸收,得到浓硫酸或发烟硫酸。
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是___________。
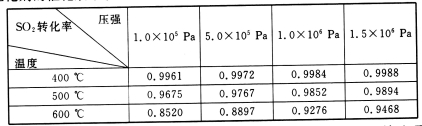
(4)欲提高SO2的反应速率和转化率,下列措施可行的是__________(填选项字母)。
A.向装置中通入氮气且保持体积不变 B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂 D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500 L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
-
硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2  SO2
SO2  SO3
SO3  H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
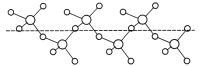
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
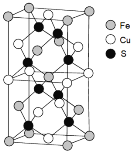
(4)绿矾是一种重要的硫酸盐,其组成可写成 [Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42- 中的O原子相联结,按图示画出含氢键的水合阴离子:______________。

(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
-
【化学——选修2:化学与技术】(15分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
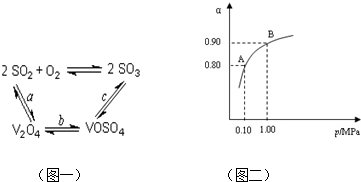
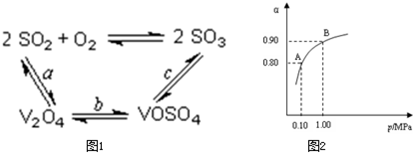
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图),其中a、c二步反应的化学方程式可表示为: 、 。
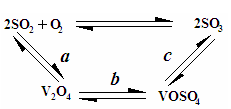
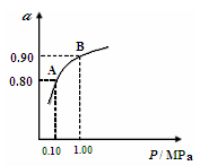
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图所示,则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:
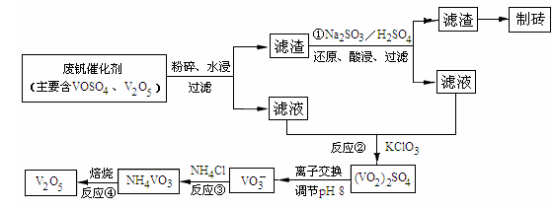
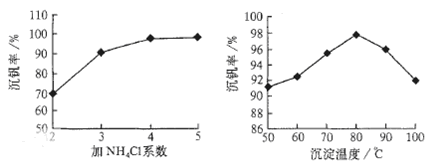
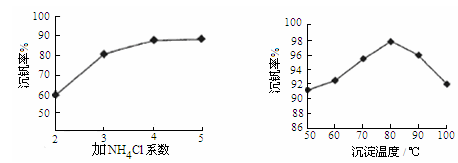
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和度: 、 。
-
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥,其主要目的是______.
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图一).其中a、c二步的化学方程式可表示为:______、______.
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图二所示.则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于______.A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是______.
-
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入______(填设备名称),其主要目的是______.
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1).其中a、c二步的化学方程式可表示为:______、______.
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图2所示.则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于______.A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是______.
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,
回收率达91.7%以上.已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣.查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水.该工艺的流程如图.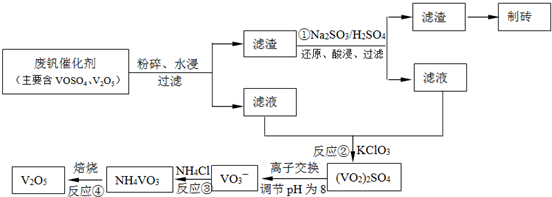
则:反应①②③④中属于氧化还原反应的是______(填数字序号),反应①的离子方程式为______.该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图试建议控制氯化铵系数和度:______、______.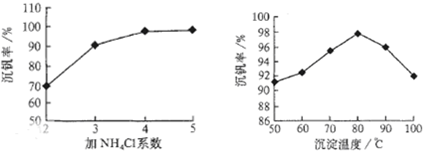
-
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称)
(2)催化氧化阶段反应2SO2(g)+O2(g)  2SO3(g) ;△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g) ;△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
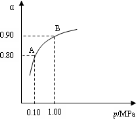
理论上要提高SO2的转化率,反应的条件应是 温 、高压(填“高”、“低”、或“常” ),但通常情况下工业生产中采用常压的原因是 。
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于 。
(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。
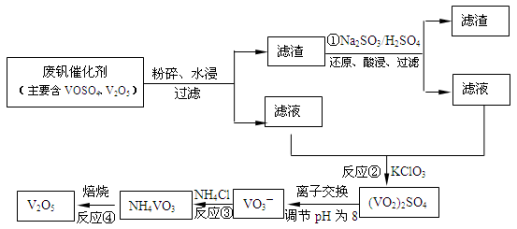
则:反应①②③④中属于氧化还原反应的是 (填数字序号),反应③的离子方程式为 。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。